5-Aminolävulinsäure
- Seiten mit Skriptfehlern
- Wikipedia:Vorlagenfehler/Vorlage:Sigma-Aldrich
- Wikipedia:Vorlagenfehler/Vorlage:Infobox Chemikalie
- Wikipedia:Wikidata-Wartung:PubChem abweichend
- Wikipedia:Wikidata-Wartung:DrugBank abweichend
- ATC-L01
- Wikipedia:Wikidata-Wartung:CAS-Nummer fehlt lokal
- Arzneistoff
- Orphan-Arzneimittel
- Aminosäure
- Ketocarbonsäure
- Stoffwechselintermediat
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||
| Name | 5-Aminolävulinsäure | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C5H9NO3 | ||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Arzneistoffangaben | |||||||||||||
| ATC-Code | |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 131,13 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Löslichkeit |
gut in Wasser[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
5-Aminolävulinsäure ist eine Aminosäure aus der Gruppe der Ketocarbonsäuren.
Gewinnung und Darstellung
Außer durch chemische Verfahren kann 5-Aminolävulinsäure auch durch biotechnologische Verfahren mit Hilfe von Bakterien (Rhodobakterium, Propionibakterium, Methanobakterium, Methanosarcina und ähnlichen) hergestellt werden.[4]
Biologische Bedeutung
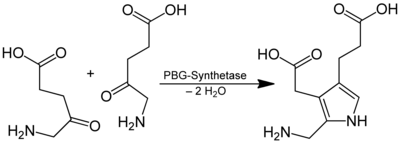
5-Aminolävulinsäure ist eine Vorstufe des Häm in der Porphyrinsynthese. Hierbei reagieren zwei Moleküle unter Abspaltung von Wasser zu Porphobilinogen:
Das Ion δ-Aminolävulinat entsteht in einer durch das mitochondriale Enzym δ-Aminolävulinatsynthase katalysierten Reaktion aus Succinyl-CoA und der Aminosäure Glycin:
- Succinyl-CoA + Glycin → δ-Aminolävulinat + CO2 + CoA
Das benötigte Succinyl-CoA entstammt dem Citratzyklus, Glycin der Biosynthese aus Serin. Im weiteren Verlauf der Hämbiosynthese reagieren zwei Moleküle δ-Aminolävulinat zum sogenannten Porphobilinogen (PBG) und zwei Wassermolekülen. Diese Reaktion wird vom Enzym δ-Aminolävulinsäure-Dehydratase (synonym: Porphobilinogen-Synthase) katalysiert.
- 2 δ-Aminolävulinat → PBG + 2 H2O
Das entstehende Porphobilinogen wird dann vom Mitochondrium ins Zytosol transportiert.
Pharmakologische Wirkung
5-Aminolävulinsäure reichert sich in Tumorzellen deutlich stärker als in unveränderten Zellen an. Dieser Effekt wird in der Photodynamischen Therapie (PDT) ausgenutzt. Nach Umwandlung in Protoporphyrin kann Lichtenergie aufgenommen und auf Sauerstoff übertragen werden, der dadurch zum sehr reaktiven Singulett-Sauerstoff wird und das Tumorgewebe, in dem das Protoporphyrin bevorzugt gebildet wurde, spezifisch zerstört.
Verwendung
Medizinisch
Die intrazelluläre Anreicherung im bösartigen Hirntumor Glioblastom und dortige Umwandlung in einen lachsrot fluoreszierenden Metaboliten ermöglicht intraoperativ eine bessere Abgrenzung des Tumorrandes zum angrenzenden Hirngewebe und erleichtert hierdurch die Tumorresektion.[5] Dazu wird 5-Aminolävulinsäure circa 2 bis 4 Stunden vor der Operation eingenommen.[6]
Äußerlich ist 5-Aminolävulinsäure im Rahmen der photodynamischen Behandlung der leichten bis mittelschweren aktinischen Keratose, einer durch intensive Einwirkung von UV-Strahlung verursachten Hauterkrankung und Präkanzerose angezeigt.[7][8] Die 5-Aminolävulinsäure wird als Gel oder Arzneipflaster auf die Hautwucherungen aufgebracht und der so behandelte Bereich nach 3 bzw. 4 Stunden mit einer Rotlichtquelle beleuchtet.
Bei einer akuten Bleivergiftung gilt ein erhöhter Spiegel der 5-Aminolävulinsäure im Urin als empfindliches Nachweisverfahren.[9][10]
Agrarwirtschaftlich
5-Aminolävulinsäure wird als Düngemittel in der Landwirtschaft eingesetzt.[11]
Einzelnachweise
- ↑ 1,0 1,1 1,2 Sicherheitsdatenblatt (Biosynth), abgerufen am 30. April 2009.
- ↑ 2,0 2,1 Römpp Online - Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- ↑ 3,0 3,1 Datenblatt 5-Aminolevulinic acid hydrochloride bei Sigma-Aldrich (PDF). Angabe des Markenparameters in Vorlage:Sigma-Aldrich fehlerhaft bzw. nicht definiert
- ↑ Mikroorganismen, welche 5-Aminolävulinat herstellen und Verfahren zur Herstellung von 5-Aminolävulinat unter Verwendung derselben (Patent-de).
- ↑ Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial. Lancet Oncol 2006; 7: 392–401.
- ↑ Fachinformation Gliolan® 30 mg/ml, Stand September 2007.
- ↑ Ameluz® 78 mg/g Gel, Zusammenfassung der Merkmale des Arzneimittels, Stand Dezember 2011.
- ↑ Fachinformation Alacare® 8 mg wirkstoffhaltiges Pflaster, Stand Februar 2011.
- ↑ Jan Koolman, Klaus-Heinrich Röhm: Taschenatlas der Biochemie. 3. Auflage, Georg Thieme Verlag, 2003, ISBN 978-3-13-759403-1, S. 192.
- ↑ Rainer Braun: Spezielle Toxikologie für Chemiker: eine Auswahl toxischer Substanzen. Vieweg+Teubner Verlag, 1999, ISBN 978-3-519-03538-1, S. 38.
- ↑ 5-Aminolävulinsäure als Düngemittel (Pentakeep).
Fertigarzneimittel
Alacare (D), Ameluz (EU), Gliolan (D)
Weblinks
- Kubisches Gel und Pflaster: Konkurrierende Darreichungsformen für 5-Aminolävulinsäure
- Daniela Steinat: Bewertung der Photodynamischen Diagnostik mit 5-Aminolävulinsäure beim Basalzellkarzinom durch 3-D-Histologie. urn:nbn:de:bsz:21-opus-15597
- Wikibooks: Porphyrinbiosynthese – Lern- und Lehrmaterialien