Natriumsulfid
- Seiten mit Skriptfehlern
- Seiten, die Referenzierungsfehler enthalten
- Wikipedia:Vorlagenfehler/Vorlage:GESTIS
- Wikipedia:Vorlagenfehler/Vorlage:Infobox Chemikalie
- Wikipedia:Wikidata-Wartung:PubChem abweichend
- Wikipedia:Wikidata-Wartung:DrugBank fehlt lokal
- Wikipedia:Vom Gesetzgeber eingestufter Gefahrstoff
- Giftiger Stoff bei Verschlucken
- Giftiger Stoff bei Hautkontakt
- Ätzender Stoff
- Umweltgefährlicher Stoff
- Wikipedia:Wikidata-Wartung:CAS-Nummer fehlt lokal
- Wikipedia:Beobachtung/Vorlage:Infobox Chemikalie/Summenformelsuche nicht möglich
- Sulfid
- Natriumverbindung
- Lebensmittelkonservierungsstoff
| Kristallstruktur | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
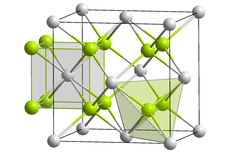
| ||||||||||
| Na+: __ / S2-: __ | ||||||||||
| Kristallsystem |
Antifluorit (kubisch) | |||||||||
| Raumgruppe |
$ Fm{\bar {3}}m $[1] | |||||||||
| Allgemeines | ||||||||||
| Name | Natriumsulfid | |||||||||
| Andere Namen |
| |||||||||
| Verhältnisformel | Na2S | |||||||||
| Kurzbeschreibung |
farb- und geruchloser, hygroskopischer Feststoff[2] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 78,05 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt |
1180 °C[2] | |||||||||
| Löslichkeit |
gut in Wasser (188 g·l−1 bei 20 °C)[2] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Natriumsulfid, Na2S ist ein Salz des Schwefelwasserstoffs H2S, einer sehr schwachen Säure.
Gewinnung und Darstellung
Schwefelhaltige Substanzen (z. B. Natriumsulfat) werden durch Glühen von Holzkohlepulver und Soda zu Natriumsulfid reduziert. Es entsteht auch beim Einleiten von Schwefelwasserstoff in Natronlauge. Im Exsikkator über Schwefelsäure oder Phosphorsäure kann der Wassergehalt auf 4 Prozent gesenkt werden. Der restliche Wasseranteil kann nur durch Erhitzen auf 700 °C in Wasserstoff entfernt werden.[5]
Im Labor kann das wasserfreie Salz durch Reduktion von Schwefel mit Natrium in wasserfreiem Ammoniak hergestellt werden.[6]
- $ \mathrm {2\ Na+S\rightarrow Na_{2}S} $
Eigenschaften
Natriumsulfid ist im reinen Zustand ein farbloser kristalliner Feststoff, der nach faulen Eiern riecht und als Nonahydrat Na2S · 9 H2O vorliegt. Die wasserfreie Variante ist geruchlos. Bei Berührung mit Säure (auch Kohlenstoffdioxid CO2, in der Atemluft) wird der giftige und brennbare Schwefelwasserstoff (Geruch!) freigesetzt. Fein verteiltes, kristallwasserfreies, Natriumsulfid kann sich an der Luft selbst entzünden, es reagiert heftig mit Oxidationsmitteln wie Kaliumpermanganat oder Kaliumdichromat. Es ist gut in Wasser löslich, die Lösung reagiert stark alkalisch und ist sehr ätzend. Die Hydrate des Natriumsulfids sind nicht brennbar, verlieren aber beim Erhitzen das gebundene Wasser. Bei längerer Lagerung färbt sich die Substanz durch langsame Reaktion mit Wasser gelblich.
Verwendung
Natriumsulfid wird u. a. in der Gerberei als Enthaarungsmittel, im Bergbau zur Erzflotation, in der organischen Chemie als Reduktionsmittel, in der Abwasserbehandlung zur Schwermetallfällung sowie zur Herstellung von Schwefelfarbstoffen verwendet. Weiterhin dient es zum Färben von Glas, zur Entfernung von NOx (Stickoxiden) aus Abgasen und zum Holzaufschluss. In der Schwarz/Weiß-Fotografie und Lithographie wird es in der Dunkelkammer zur Schwefeltonung (Sepia-Tonung) eingesetzt.
Einzelnachweise
- ↑ Eduard Zintl, A. Harder, B. Dauth: Gitterstruktur der oxyde, sulfide, selenide und telluride des lithiums, natriums und kaliums. In: Zeitschrift für Elektrochemie und Angewandte Physikalische Chemie. 1934, 40, S. 588–93.
- ↑ 2,0 2,1 2,2 2,3 2,4 Eintrag zu Natriumsulfid in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ Thieme Chemistry (Hrsg.): RÖMPP Online - Version 3.5. Georg Thieme Verlag KG, Stuttgart 2009.
- ↑ 4,0 4,1 Referenzfehler: Es ist ein ungültiger
<ref>-Tag vorhanden: Für die Referenz namensESISwurde kein Text angegeben. - ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 358-60.
- ↑ J.-H. Also, P. Boudjouk: Hexamethyldisilathiane. In: Inorganic Syntheses. 1992, 29, S. 30, doi:10.1002/9780470132609.ch11.
