Pyritinol
- Seiten mit Skriptfehlern
- Wikipedia:Vorlagenfehler/Vorlage:Sigma-Aldrich
- Wikipedia:Vorlagenfehler/Vorlage:Infobox Chemikalie
- Wikipedia:Wikidata-Wartung:PubChem abweichend
- Wikipedia:Wikidata-Wartung:DrugBank fehlt lokal
- ATC-N06
- Wikipedia:Keine GHS-Gefahrstoffkennzeichnung verfügbar
- Wikipedia:Wikidata-Wartung:CAS-Nummer fehlt lokal
- Pyridin
- Organisches Disulfid
- Polyol
- Arzneistoff
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
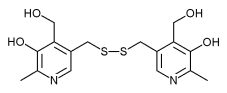
| ||||||||||
| Allgemeines | ||||||||||
| Freiname | Pyritinol | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C16H20N2O4S2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Arzneistoffangaben | ||||||||||
| ATC-Code | ||||||||||
| Wirkstoffklasse |
Antidementivum | |||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 368,47 g·mol−1 | |||||||||
| Schmelzpunkt |
216-217 °C[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Pyritinol (Handelsname: Encephabol®, Hersteller: Merck KGaA) ist ein Arzneistoff, der als Antidementivum zur Behandlung der senilen Demenz verwendet wird.
Synthese
Die Verbindung kann in einer dreistufigen Synthese aus Pyridoxin hergestellt werden.[4] Im ersten Schritt erfolgt die Umwandlung von Pyridoxin Hydrochlorid in konzentrierter Bromwasserstoffsäure zur entsprechenden Bromverbindung.[5] Diese wird dann mit Kaliumethylxanthogenat umgesetzt. Die Zielverbindung entsteht durch die Dimerisierung des erhaltenen Xanthogenats in Gegenwart von Ammoniak.[6]
Pharmakokinetik
Pharmakologisch wirksam sind die aus der Spaltung an der Disulfidbrücke hervorgehenden Pyridoxin-Reste (Vitamin B6). Die Eliminationshalbwertzeit beträgt ungefähr 6 Stunden, bei einer Bandbreite von 2,5 bis 8 Stunden. Die Verfügbarkeit liegt bei über 80 %. Nach oraler Gabe stellt sich das Wirkungsmaximum nach ca. 30 bis 60 min ein. Der Wirkstoff passiert die Blut-Hirn-Schranke und reichert sich in der grauen Substanz an. Der Wirkstoff und die ebenfalls pharmakologisch wirksamen Metaboliten und ihre Konjugate werden innerhalb von 24h zu über 70 % über die Nieren ausgeschieden, zu 5 % mit dem Fäzes. Es wurde keine Anreicherung von Pyritinol im Organismus beobachtet.
Weblinks
Einzelnachweise
- ↑ Paul, B.; Korytnyk, W.: Selective esterifications and acyl rearrangements in vitamin B6 in Tetrahedron 25 (1969) 1071–1087, doi:10.1016/S0040-4020(01)82680-6.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Datenblatt Pyritinol bei Sigma-Aldrich (PDF).
- ↑ A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances - Synthesis, Patents, Applications. 4. Auflage. Thieme 2001, ISBN 3-13-115134-X.
- ↑ McCasland, G.; Gottwald, L.; Furst, A.: 4,5-Dihalo and 3-Amino Analogs of Pyridoxine. New Route to 4-Deoxypyridoxine in J. Org. Chem. 26 (1961) 3541–3543, doi:10.1021/jo01067a622.
- ↑ Patente DE 1,135,460 (E. Merck AG 1958); US 3,010,966 (E. Merck AG 1961).