Bislang unbekannte Bindestelle an Zellmembran identifiziert
Bio-News vom 07.09.2022
Die Wechselwirkungen von Proteinen und Lipiden (Fetten) in Membranen untersucht ein Forschungsteam mit Hilfe von Modellrechnungen. Im fassförmigen Tubby-Protein fanden sie so eine bislang unbekannte Bindungsstelle, die zur Aufklärung verschiedener Krankheitsbilder beitragen könnte.
Funktioniert das Tubby-Protein in unseren Zellen nicht, werden Störungen im Energiehaushalt, Fettleibigkeit, Abbau der Netzhaut und Gehörverlust beobachtet. Die genauen Hintergründe für diese Fehlfunktionen sind unklar, daher sind Erkenntnisse zur Funktionsweise von Tubby wichtig. Die Familie der Tubby-Proteine spielt eine wichtige Rolle für den Transport von Proteinen in der Zellmembran.
Publikation:
Veronika Thallmair, Lea Schultz, Wencai Zhao, Siewert Jan Marrink, Dominik Oliver, Sebastian Thallmair
Two cooperative binding sites sensitize PI(4,5)P2 recognition by the tubby domain
Sci. Adv. 8, eabp9471 (2022)
In einer genau passenden „Tasche“ binden sie Rezeptorproteine und schleusen diese in feine Härchen, die primären Zilien. Diese Zilien fungieren als Antennen, die Signale außerhalb der Zelle erkennen und ins Zellinnere weiterleiten. Ist ihre Funktion und damit die Signalweiterleitung gestört, können Krankheiten auftreten (Ziliopathien).
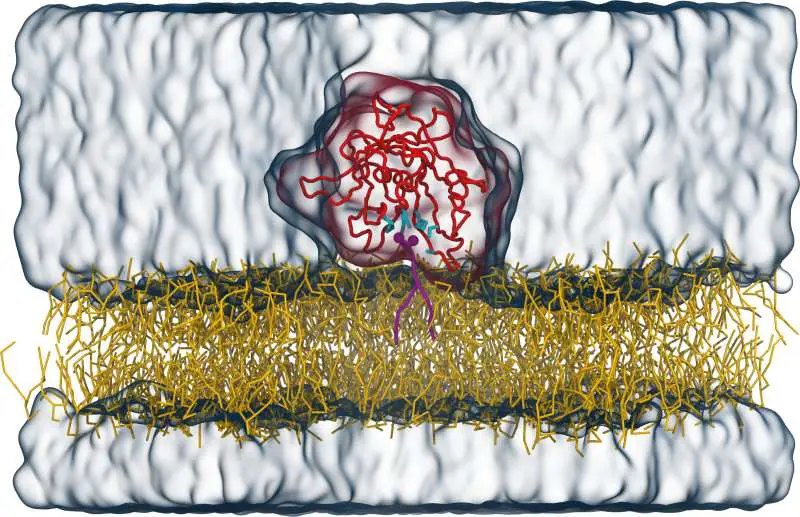
Damit Tubby funktioniert, muss es an die Innenseite der Membran andocken, und zwar über ein spezifisches Lipid (PI(4,5)P2), das ausschließlich in der Zellmembran vorkommt. Das Team um FIAS-Fellow Dr. Sebastian Thallmair sowie Professor Dr. Dominik Oliver (Universität Marburg) und Professor Dr. Siewert-Jan Marrink (Universität Groningen, Niederlande) untersuchte den Bindungs-mechanismus von Tubby an dieses Signallipid genauer.
In ihrer aktuellen Veröffentlichung beschreiben sie eine bisher unbekannte Bindestelle des Tubby-Proteins. „Mit computergestützten Berechnungen identifizierten wir eine zweite Bindungstasche für das Signallipid, neben der bereits bekannten“, so Thallmair. Grundlage für diese Modellrechnungen sind die bekannte Protein-Struktur sowie Informationen zu chemischen und physikalischen Bindungsvorlieben oder Abstoßungsreaktionen einzelner Atomgruppen.
Um die Berechnungen zu überprüfen, setzte das Team anschließend Mutationen in der prognostizierten Bindestelle – die daraufhin nicht mehr funktioniert. Dies bestätigte, dass die zweite Bindungstasche in lebenden Zellen unverzichtbar für die Funktion von Tubby ist. Sie trägt maßgeblich dazu bei, dass Tubby an der Zellmembran andocken kann. Darüber hinaus zeigte das Team, dass beide Bindestellen kooperieren. „Das bedeutet, dass erstaunlicherweise zwei gebundene Signallipide mehr als doppelt so stark wirken wie nur ein gebundenes Signallipid“, erklärt Thallmair.
Fluoreszenzmarkiertes Tubby-Protein wird auch als Marker verwendet, um Rückschlüsse auf die Lipid-Konzentration verschiedener Membranbereiche zu erhalten. „Wir wollen beispielsweise verstehen, wie das Signallipid - nachdem es abgebaut wurde - wieder synthetisiert wird“, sagt Thallmair. „Denn es wird offensichtlich nur in bestimmten, eng begrenzten Bereichen der Zellmembran synthetisiert“. Tubby soll dabei helfen, diese Bereiche zu identifizieren.
Diese Newsmeldung wurde mit Material der Philipps-Universität Marburg via Informationsdienst Wissenschaft erstellt.