Fortschritt in der hochauflösenden Mikroskopie
Bio-News vom 17.12.2018
Liefert die Expansionsmikroskopie originalgetreue Bilder von Zellstrukturen? Das war bislang nicht sicher. Eine neue Publikation in „Nature Methods“ zeigt nun erstmals, dass die Methode tatsächlich zuverlässig funktioniert.
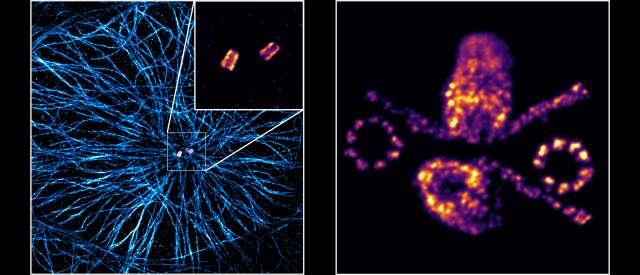
Mit dem Mikroskop tiefer und tiefer in die Innenwelt von Zellen eintauchen. Den Zellkern und andere Strukturen immer genauer abbilden. Möglichst detaillierte Ansichten von zellulären Multiprotein-Komplexen bekommen. All das sind Ziele, die der Mikroskopie-Experte Markus Sauer am Biozentrum der Julius-Maximilians-Universität Würzburg (JMU) verfolgt. Zusammen mit Forschungsteams aus Genf und Lausanne hat er nun gezeigt, dass eine bislang angezweifelte Methode der hochauflösenden Super-Resolution-Mikroskopie doch zuverlässig ist.
Die Rede ist von der Ultrastruktur-Expansionsmikroskopie (U-ExM). Vereinfacht gesagt funktioniert sie so: Die abzubildenden Zellstrukturen, in diesem Fall Multiprotein-Komplexe, werden in einem Polymer verankert – ganz so, als würde man Kerzen in einen Adventskranz stecken oder einen Weihnachtsbaum schmücken.
Publikation:
Davide Gambarotto, Fabian U. Zwettler, Maeva Le Guennec, Marketa Schmidt-Cernohorska, Denis Fortun, Susanne Borgers, Jörn Heine, Jan-Gero Schloetel, Matthias Reuss, Michael Unser, Edward S. Boyden, Markus Sauer, Virginie Hamel & Paul Guichard
Imaging cellular ultrastructures using expansion microscopy (U-ExM)
Nature Methods, 17. Dezember 2018
DOI: 10.1038/s41592-018-0238-1
Zellstrukturen werden nicht verzerrt
Dann werden die Wechselwirkungen zwischen den Proteinen zerstört und das Polymer mit Flüssigkeit zum Aufquellen gebracht. „Das Polymer dehnt sich dann in alle Raumrichtungen gleichmäßig um den Faktor vier aus. Dabei bleiben die Antigene erhalten und können nachträglich mit farbstoffmarkierten Antikörpern angefärbt werden“, sagt Professor Sauer. Bislang seien Viele in der Wissenschaft der Meinung gewesen, dass die Expansion des Polymers nicht gleichmäßig verlaufe und man am Ende eine verzerrte Darstellung bekomme.
„Wir können mit U-ExM aber wirklich ultrastrukturelle Details abbilden, die Methode ist verlässlich“, betont Sauer. „Und wir bekommen mit ihr ein Bild, das vierfach höher aufgelöst ist als mit den bisherigen Standardmethoden der Mikroskopie.“
Zentriolen machten den Anfang
Das beweist das Forschungsteam aktuell im Journal „Nature Methods“ am Beispiel der Zentriolen. Diese zylinderförmigen Proteinstrukturen spielen bei der Zellteilung eine wichtige Rolle; der Würzburger Biologe Theodor Boveri hat sie erstmals 1888 beschrieben.
Die Zentriolen wurden für das Experiment ausgewählt, weil ihre Struktur schon sehr gut bekannt ist. „Dadurch konnten wir im Vergleich mit elektronenmikroskopischen Aufnahmen erkennen, dass U-ExM zuverlässig arbeitet und selbst die Chiralität der Mikrotubuli-Tripletts erhält, aus denen die Zentriolen aufgebaut sind“, erklärt Sauer.
Als nächstes wollen die JMU-Forscher mit dieser Mikroskopiemethode Zellstrukturen analysieren, von denen man bislang noch kein so genaues Bild hat. „Das sind zum Beispiel Unterstrukturen der Zentriolen, die Kernporenkomplexe oder synaptonemale Komplexe. Sie alle werden jetzt erstmals mit Licht- statt Elektronenmikroskopie mit molekularer Auflösung zugänglich“, so Sauer.
Diese Newsmeldung wurde via Informationsdienst Wissenschaft erstellt.