Gentherapie macht taube Mäuse hörend
Bio-News vom 01.02.2019
Hörverlust kann bislang nur mit Prothesen, wie Hörgeräten oder Cochlea-Implantaten, behandelt werden. Eine neuartige Gentherapie könnte dies in bestimmten Fällen in der Zukunft überflüssig machen. Göttinger Forschern gelang es, bei tauben Mäusen ein fehlendes Gen mittels Viren in das Innenohr zu schleusen und damit das Hören wiederherzustellen. Veröffentlicht in der Fachzeitschrift „EMBO Molecular Medicine“.
Taubheit betrifft etwa eines von 1.000 neugeborenen Kindern und ist damit die häufigste angeborene Sinnesbeeinträchtigung. Über 140 verschiedene Gene sind derzeit bekannt, deren Defekte zu Hörminderung führen. In 75 Prozent der Fälle wird Taubheit rezessiv vererbt. Das bedeutet, es ist keine intakte Genkopie mehr vorhanden, die die Zellen als Bauplan für ein bestimmtes Protein benötigen.
Bei der Otoferlin-bedingten Taubheit fehlt das Protein Otoferlin, die Sinneszellen des Innenohrs können keine Signale mehr an den Hörnerv weiterleiten. Weltweit versuchen Forscher bereits seit Längerem, für diese Form der Taubheit eine Gentherapie zu entwickeln.
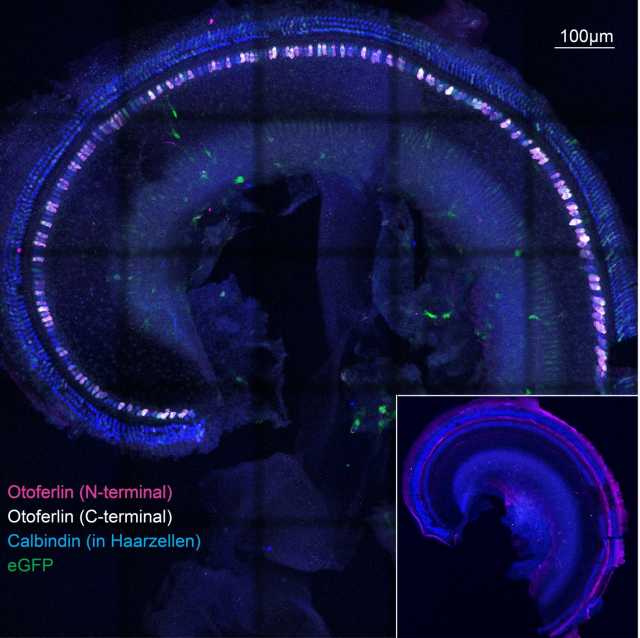
Göttinger Forschern ist es jetzt gelungen, bei tauben Mäusen das fehlende Gen für die Herstellung des Proteins Otoferlin mittels Viren in das Innenohr zu schleusen. Mit Hilfe von fluoreszierenden Antikörpern gelang es, neu gebildetes Otoferlin in den Sinneszellen nachzuweisen. Der Otoferlin-Bauplan zeigte sich korrekt und frei von Virussequenzen. Die Wissenschaftler konnten unter anderem nachweisen, dass das so hergestellte Otoferlin funktioniert und die ursprünglich tauben Mäuse tatsächlich wieder hören.
Publikation:
Hanan Al-Moyed, Andreia P. Cepeda, Sangyong Jung, Tobias Moser, Sebastian Kügler, Ellen Reisinger
A dual-AAV approach restores fast exocytosis and partially rescues audi-tory function in deaf otoferlin knock-out mice
EMBO Molecular Medicine, 2019, 11(1) pii: e9396
Die Forschungserkenntnisse sind das Ergebnis der Zusammenarbeit einer Gruppe von Wissenschaftlern der Klinik für Hals-, Nasen-, Ohrenheilkunde an der Universitätsmedizin Göttingen (UMG) unter Leitung von Privatdozentin Dr. Ellen Reisinger mit dem Virusspezialisten Dr. Sebastian Kügler von der Klinik für Neurologie, UMG, sowie Forschern des Instituts für Auditorische Neurowissenschaften, UMG. Gefördert wurde die Arbeit durch eine Forschungsunterstützung der US-Startup Firma Akouos sowie den Sonderforschungsbereich (SFB) 889 „Zelluläre Mechanismen der Sensorischen Verarbeitung“ und das Center for Nanoscale Microscopy and Physiology of the Brain (CNMPB) Göttingen. Publiziert wurden die Forschungsergebnisse in der renommierten Fachzeitschrift „EMBO Molecular Medicine“.
Die Forscher konnten zudem zeigen, dass die synaptische Übertragung beinahe so gut funktionierte wie in gesunden Mäusen. Auch einen Hörtest absolvierten die einst tauben Mäuse erfolgreich: Hierzu wurden den Mäusen Klick-Geräusche vorgespielt, die bei hörenden Mäusen, nicht aber bei tauben Mäusen, elektrische Hirnstammpotentiale auslösen. Solche Potentiale zeigten sich nun auch bei den Virus-behandelten vormals tauben Mäusen. Für die Göttinger Forscher gilt dies als Beweis dafür, dass mit der Gentherapie bei den Mäusen das Gehör prinzipiell wiederherstellt werden kann.
„Die größte Schwierigkeit bestand darin, einen geeigneten molekularen Transporter für das ungewöhnlich große Gen zu finden, da allein die kodierende Sequenz nahezu 6.000 Basenpaare umfasst“, sagt Hanan Al-Moyed, Klinik für Hals-, Nasen-, Ohrenheilkunde der UMG, Erstautorin der Studie. Für derartige DNA-Transporte werden meist Viren eingesetzt, die gentechnisch so verändert wurden, dass sie statt der Virus-Gene die therapeutischen Gene erhalten. Solche Viren können sich im Körper nicht weiter vermehren. Die derzeit für Gentherapien bevorzugt eingesetzten Viren (sogenannte Adeno-Assoziierte Viren, AAV) transportieren jedoch nur bis zu 4.700 Basenpaare an fremder DNA. Andere gentherapeutisch verwendete Viren, die größere DNA-Sequenzen transportieren können, erwiesen sich als zu ineffizient für den Transport in die Sinneszellen des Innenohrs.
„Das war in etwa so, wie wenn man mit dem Kleinwagen losfährt, um Möbel einzukaufen, die dann nicht in den Kofferraum passen, aber ein größerer Transporter könnte nicht in die Wohnstraße einbiegen“, beschreibt Hanan Al-Moyed die Situation.
Der Durchbruch gelang den Göttinger Forschern mit einem Trick: Sie teilten die kodierende Sequenz von Otoferlin in zwei Teile, diese sollten dann von zwei separaten AAV transportiert werden. Damit sich die beiden Teile in den Zellen wieder zusammenfügen, kam den Forschern eine bestimmte Eigenschaft der DNA dieser Viren zunutze: Sie bilden im Kern einer Zelle ein langes, ringförmiges Multimer, das aus der DNA von bis zu 80 Einzelviren besteht. Liegen die Teilstücke in diesem Multimer zufällig in der richtigen Orientierung hintereinander, kann die Zelle die vollständige Otoferlin-mRNA (also die Arbeits-Kopie des Bauplans) ablesen. An der Schnittstelle jedoch bleiben noch kleine Teile des Virus-Genoms enthalten. Hier bauten die Forscher DNA-Signalsequenzen ein, die die Zelle veranlassen, diese Teile aus der mRNA herauszuschneiden.
Als Nächstes suchen die Wissenschaftler nach einem Weg, die Viren weiter zu verbessern. „Wir arbeiten intensiv an einer Strategie, um etwas höhere Proteinmengen in den Sinneszellen zu erreichen und somit das Hörvermögen vollständig wiederherstellen“, sagt Priv.-Doz. Dr. Ellen Reisinger, Seniorautorin der Studie. Gelingt dies, rückt eine Gentherapie für diese Form der Taubheit auch bei Menschen in greifbare Nähe. Ein kooperierendes US-Unternehmen führt bereits weitere Experimente wie Toxizitätstests durch, um baldmöglichst mit klinischen Studien beginnen zu können.
„Da die Sinneszellen im Innenohr unser ganzes Leben bestehen, ohne ausgetauscht zu werden, und die Virus-DNA typischerweise stabil in den Zellkernen bleibt, haben wir die Hoffnung, dass auch die Gentherapie nur einmal durchgeführt werden muss“, sagt Ellen Reisinger. Die Otoferlin-bedingte Taubheit habe damit gute Chancen, die erste Form von angeborener Taubheit zu sein, die mit Gentherapie behandelt werden kann, so Reisinger.
Die neu gewonnenen Erkenntnisse möchte Priv.-Doz. Dr. Reisinger nutzen, um zukünftige Therapien für weitere Taubheitsformen zu entwickeln. Möglich erscheint eine Gentherapie nach der Geburt jedoch nur für solche Formen von Taubheit, bei denen alle Zellen des Innenohrs vorhanden sind. Wird das Taubheitsgen hingegen während der Embryonalentwicklung für die Reifung der Zellen des Innenohrs benötigt, was bei nicht wenigen Formen der Taubheit der Fall ist, kann eine spätere Gentherapie das Hören nicht wieder-bringen.
„Das war in etwa so, wie wenn man mit dem Kleinwagen losfährt, um Möbel einzukaufen, die dann nicht in den Kofferraum passen, aber ein größerer Transporter könnte nicht in die Wohnstraße einbiegen“, beschreibt Hanan Al-Moyed die Situation.
Der Durchbruch gelang den Göttinger Forschern mit einem Trick: Sie teilten die kodierende Sequenz von Otoferlin in zwei Teile, diese sollten dann von zwei separaten AAV transportiert werden. Damit sich die beiden Teile in den Zellen wieder zusammenfügen, kam den Forschern eine bestimmte Eigenschaft der DNA dieser Viren zunutze: Sie bilden im Kern einer Zelle ein langes, ringförmiges Multimer, das aus der DNA von bis zu 80 Einzelviren besteht. Liegen die Teilstücke in diesem Multimer zufällig in der richtigen Orientierung hintereinander, kann die Zelle die vollständige Otoferlin-mRNA (also die Arbeits-Kopie des Bauplans) ablesen. An der Schnittstelle jedoch bleiben noch kleine Teile des Virus-Genoms enthalten. Hier bauten die Forscher DNA-Signalsequenzen ein, die die Zelle veranlassen, diese Teile aus der mRNA herauszuschneiden.
Als Nächstes suchen die Wissenschaftler nach einem Weg, die Viren weiter zu verbessern. „Wir arbeiten intensiv an einer Strategie, um etwas höhere Proteinmengen in den Sinneszellen zu erreichen und somit das Hörvermögen vollständig wiederherstellen“, sagt Priv.-Doz. Dr. Ellen Reisinger, Seniorautorin der Studie. Gelingt dies, rückt eine Gentherapie für diese Form der Taubheit auch bei Menschen in greifbare Nähe. Ein kooperierendes US-Unternehmen führt bereits weitere Experimente wie Toxizitätstests durch, um baldmöglichst mit klinischen Studien beginnen zu können.
„Da die Sinneszellen im Innenohr unser ganzes Leben bestehen, ohne ausgetauscht zu werden, und die Virus-DNA typischerweise stabil in den Zellkernen bleibt, haben wir die Hoffnung, dass auch die Gentherapie nur einmal durchgeführt werden muss“, sagt Ellen Reisinger. Die Otoferlin-bedingte Taubheit habe damit gute Chancen, die erste Form von angeborener Taubheit zu sein, die mit Gentherapie behandelt werden kann, so Reisinger.
Die neu gewonnenen Erkenntnisse möchte Priv.-Doz. Dr. Reisinger nutzen, um zukünftige Therapien für weitere Taubheitsformen zu entwickeln. Möglich erscheint eine Gentherapie nach der Geburt jedoch nur für solche Formen von Taubheit, bei denen alle Zellen des Innenohrs vorhanden sind. Wird das Taubheitsgen hingegen während der Embryonalentwicklung für die Reifung der Zellen des Innenohrs benötigt, was bei nicht wenigen Formen der Taubheit der Fall ist, kann eine spätere Gentherapie das Hören nicht wieder-bringen.
Diese Newsmeldung wurde via Informationsdienst Wissenschaft erstellt.