Neue Cas9-Variante macht Genom-Editierung noch präziser
Bio-News vom 03.03.2020
Forschende in Berlin und Halle haben eine spezifischere CRISPR-Cas9 Genschere entwickelt.
CRISPR-Cas9 kann DNA spezifisch an definierten Stellen schneiden und hat damit die Genetik revolutioniert. Forscher benutzen die sogenannte Genschere unter anderem dazu, Gene gezielt auszuschalten oder neue DNA Fragmente in das Genom einzufügen. Aber egal wie spezifisch das Cas9-Enzym ist - manchmal schneidet es dort, wo es nicht schneiden soll. Wissenschaftler der Max-Planck-Forschungsstelle für die Wissenschaft der Pathogene in Berlin und der Medizinischen Fakultät der Martin-Luther-Universität Halle-Wittenberg haben nun eine Cas9-Variante entwickelt, die die Editierung von Genen noch spezifischer macht.
Publikation:
Bratovic M*, Fonfara I*, Chylinski K, Galvez EJC, Sullivan TJ, Boerno S, Timmermann B, Boettcher M and Charpentier E. (*Gleicher Beitrag)
Bridge Helix Arginines Play a Critical Role in Cas9 Sensitivity to Mismatches
Nat. Chem. Biol.; 2. März 2020
DOI: 10.1038/s41589-020-0490-4
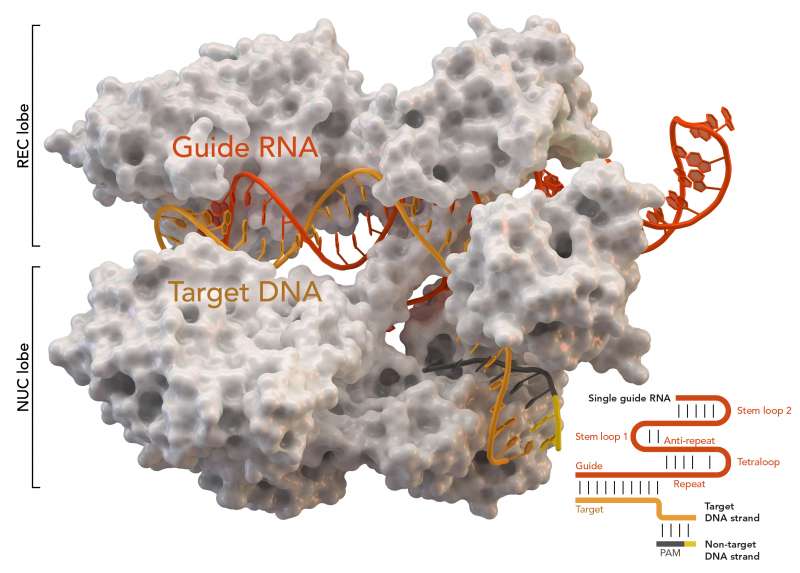
Damit Cas9 sein DNA Ziel schneiden kann, muss es zunächst durch eine so genannte “guide-RNA” an die Stelle im Genom geleitet werden, an der es schneiden soll. Die guide-RNA enthält die zur Zielstelle komplementäre Sequenz und funktioniert wie eine Postleitzahl, die Cas9 an sein Ziel bringt. "Manchmal kann Cas9 jedoch auch DNA-Sequenzen schneiden, die dem eigentlichen Ziel sehr ähnlich sind, so genannte Off-Targets", erklärt Emmanuelle Charpentier, Direktorin der Max-Planck-Forschungsstelle für die Wissenschaft der Pathogene.
Diese unerwünschte Aktivität von CRISPR-Cas9 kann zu Ungenauigkeiten bei der Bearbeitung des Genoms führen. "Ein unbeabsichtigter Schnitt an der falschen Stelle im menschlichen Genom kann tiefgreifende Folgen haben. Deshalb brauchen wir ein spezifischeres System", sagt Michael Böttcher, Juniorprofessor an der Medizinischen Fakultät der Martin-Luther-Universität.
Wissenschaftler versuchen daher, die Spezifität von Cas9 mit verschiedensten Ansätzen zu optimieren. In der aktuellen Studie konzentrierte sich das Forscherteam aus Berlin und Halle auf eine evolutionär konservierte Domäne von Cas9, die so genannte Brückenhelix.
Aminosäuren bilden stabile Schleife
Die Forscher haben herausgefunden, dass die Brückenhelix eine entscheidende Rolle bei dem Mechanismus spielt, durch den Cas9 mit seiner guide-RNA und der DNA Zielstelle interagiert. Sie identifizierten eine Gruppe von Aminosäuren, die mit dem Phosphat-Rückgrat der guide-RNA in Kontakt kommen und dadurch die Bildung einer stabilen Schleife ermöglichen, die für die Aktivität von Cas9 essentiell ist. In dieser Schleife paaren sich die Basen der von Cas9-gebundenen guide-RNA mit dem komplementären Strang der DNA-Zielsequenz und verdrängen dabei den zweiten DNA-Strang. Dadurch kann Cas9 beide DNA Stränge schneiden.
Die Forscher haben die identifizierten Aminosäuren verändert und so neue Cas9-Varianten entwickelt. Dabei haben sie festgestellt, dass mehrere dieser Varianten viel seltener als das ursprüngliche Cas9-Enzym an Stellen schneiden, die nicht der eigentlichen Ziel-DNA entsprechen. Eine der getesteten Varianten, genannt R63A/Q768A, erhöht die Spezifität von Cas9 auch in menschlichen Zellen. "Unsere Ergebnisse bieten eine neue Grundlage für die weitere Optimierung von CRISPR-Cas9. Darüber hinaus müssen wir mehr über die Biochemie der CRISPR-Cas-Systeme lernen, damit wir sie weiter verbessern können", sagt Charpentier.
Diese Newsmeldung wurde mit Material der Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. via Informationsdienst Wissenschaft erstellt.