Nonstop-Transport von Frachten in Nanomaschinen
Bio-News vom 20.11.2018
Max-Planck-Forscher entdecken die Nanostruktur von molekularen Zügen und den Grund für reibungslosen Transport in den Antennen der Zelle.
Eine Zelle bewegt sich ständig umher, tastet ihre Umgebung ab und sendet Signale an andere Zellen. Das ist wichtig, damit eine Zelle richtig funktionieren kann. Verantwortlich für diese Aufgaben sind Zilien, antennenartige Strukturen, die aus den meisten Zellen von Wirbeltieren herausragen. Wenn sich diese nicht richtig entwickeln, führt das zu Fehlfunktionen und damit zu zahlreichen menschliche Erkrankungen. Der Aufbau und die Erhaltung von Zilien wird durch eine Transportmaschine, den Intraflagellar Transport (IFT), koordiniert.
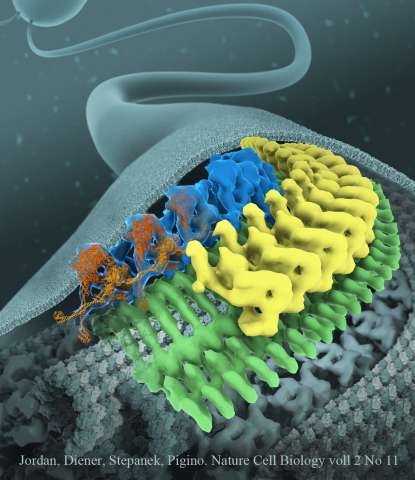
Diese bewegt sich auf einem zweigleisigen System in Zug-ähnlichen Strukturen entlang des mikrotubulären Skeletts der Zilien. Bisher war nicht nur die Struktur der IFT-Züge unbekannt, sondern auch, wie die beiden gegenläufig ausgerichteten Molekularmotoren, Kinesin und Dynein, daran gehindert werden, sich gegenseitig zu stören und es schaffen, die IFT-Züge gleichmäßig und konstant zu bewegen. Die Forschungsgruppe um Gaia Pigino am Max-Planck-Institut für molekulare Zellbiologie und Genetik (MPI-CBG) in Dresden hat diese beiden offenen Fragen mithilfe der Kryoelektronenmikroskopie beantwortet und ihre Ergebnisse in der Fachzeitschrift Nature Cell Biology veröffentlicht.
Publikation:
Mareike A. Jordan, Dennis R. Diener, Ludek Stepanek & Gaia Pigino
The cryo-EM structure of intraflagellar transport trains reveals how dynein is inactivated to ensure unidirectional anterograde movement in cilia
Nature Cell Biology, October 15, 2018
DOI: https://doi.org/10.1038/s41556-018-0213-1
Als Menschen verlassen wir uns auf unsere Sinne, wir Hören, Sehen, Schmecken oder Riechen um unsere Umwelt zu erkunden. Einzelne Zellen dagegen nehmen ihre Umwelt durch antennenartige Strukturen wahr, die als Zilien bekannt sind. Eine Zilie kann Licht sowie chemische und mechanische Reize in molekulare Signale umwandeln, die die Zelle interpretiert und darauf reagiert. Darüber hinaus ermöglichen Zilien den Zellen miteinander zu kommunizieren und sich zu bewegen. Diese sensorischen, signal-gebenden und motorischen Funktionen der Zilien erklären, warum Fehlfunktionen ein so breites Spektrum an menschlichen Krankheiten verursachen können, einschließlich Netzhautdegeneration, polyzystischer Nierenerkrankung, Bardet-Biedl-Syndrom oder Herzerkrankungen. Angesichts dieser entscheidenden Rolle ist es für die Zilien von entscheidender Bedeutung, dass bei ihrem Aufbau nichts schiefläuft.
Zilien bestehen aus zahlreichen Komponenten, die auf kleinen molekularen Maschinen, den IFT-Zügen, transportiert werden. Diese Züge bewegen sich entlang des mikrotubulären Skeletts der Zilien und liefern molekulare Bausteine an die wachsende Spitze der Zilien, bevor diese zurück zum Zellkörper fahren. IFT-Züge sind das schnellste und effizienteste Transportsystem, das je in Zellen beobachtet wurde. Im Jahr 2016 hat die Forschungsgruppe von Gaia Pigino entdeckt, dass Zellen Zusammenstöße der Züge verhindern, indem diese auf verschiedenen Mikrotubuli-Schienen in entgegengesetzte Richtungen fahren.
Dennoch blieben nach dieser Studie einige Fragen offen: Wie genau sieht die Molekularstruktur von IFT-Zügen aus und wie werden die beiden molekularen Motoren, Kinesin und Dynein, gesteuert? Diese Motorproteine ziehen den IFT-Zug entlang der Gleise: Während Kinesin voll beladene Züge an die Spitze der Zilien bringen, zieht Dynein die Züge zurück zum Zellkörper. Mareike Jordan, die Erstautorin der Studie, erklärt: „Wir wussten nicht, wie Dynein an die Spitze der Zilien gelangen konnte, ohne den Zug dabei in die entgegengesetzte Richtung zu ziehen. Dies würde zu einem Tauziehen zwischen Dynein und Kinesin führen. Nachdem wir herausgefunden hatten, wie die IFT-Züge strukturiert sind, konnten wir sehen, wie Dynein als Fracht auf den Zügen verankert ist. Dabei verhindern zwei Mechanismen ein Tauziehen der molekularen Motoren: Dynein wird von den IFT-Zügen Huckepack getragen und so von der Mikrotubuli-Schiene entfernt gehalten. Außerdem sind die molekularen ‚Beine‘ des Dyneins fest überkreuzt, so dass es nicht entlang der Mikrotubuli laufen kann. An der Ziliarspitze wird Dynein abgesetzt, aktiviert und dazu genutzt, Züge zurück zum Zellkörper zu ziehen.“
Die Technologie, die diese Entdeckungen ermöglichte, ist die Kryoelektronenmikroskopie (Kryo-EM), ein Verfahren, bei dem Elektronen anstelle von Licht verwendet werden, um gefrorene biologische Proben, wie beispielsweise Proteine, in ihrer zellulären Umgebung abzubilden und 3D-Modelle ihrer Molekularstruktur zu erhalten. „Mit der Kryo-EM hier am MPI-CBG konnten wir die intraflagellaren Transportmaschinen in ihrem natürlichen Umfeld innerhalb der Zelle visualisieren“, sagt Gaia Pigino, die die Studie betreute. Ihr Fazit: „Diese Studie zeigt uns wichtige Mechanismen, die Zellen für eine robuste Ziliaranlage benötigen. Unsere Arbeit an der molekularen Struktur und Funktion der IFT-Maschine ist wichtig, um die vielen menschlichen Erkrankungen zu verstehen, die mit der Fehlentwicklung von Zilien zusammenhängen.“
Diese Newsmeldung wurde via Informationsdienst Wissenschaft erstellt.