Wie Abwehrzellen scharf geschaltet werden
Bio-News vom 01.08.2018
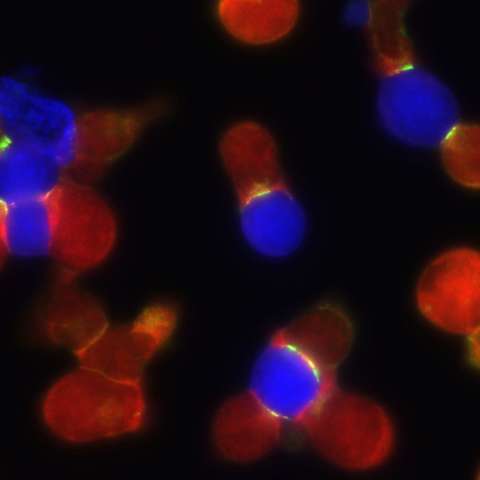
HZI-Forscher haben die Ausbildung von immunologischen Synapsen untersucht, über die Immunzellen Informationen miteinander austauschen
Das Immunsystem schützt den menschlichen Körper vor Krankheitserregern und hält ihn so gesund. Dazu müssen die Immunzellen jedoch Eindringlinge auch als solche erkennen und als gefährlich oder harmlos einstufen können. Diese Aufgaben teilen sich verschiedene Zelltypen: Hat eine Immunzelle einen Fremdkörper entdeckt, präsentiert sie diesen einer anderen Abwehrzelle. Die beiden Zellen bilden an ihrer Kontaktfläche eine charakteristische ringförmige Struktur, die immunologische Synapse, über die sie Informationen austauschen. Sitzen alle Bausteine dieser Synapse an der richtigen Stelle, führt das zur Aktivierung der Abwehrzelle. Wissenschaftler des Helmholtz-Zentrums für Infektionsforschung (HZI) und des Braunschweig Integrated Centre of Systems Biology (BRICS) haben in Zusammenarbeit mit Forschern an der University of Oxford (UK) nun die dynamische Anordnung dieser Bausteine am Computer simuliert und konnten so auf die zugrundeliegenden Mechanismen schließen, wie funktionale Synapsen entstehen. Ihre Ergebnisse veröffentlichten die Wissenschaftler nun im Fachjournal Cell Reports. Das BRICS ist eine gemeinsame Einrichtung des HZI und der Technischen Universität Braunschweig.
Publikation:
Anastasios Siokis, Philippe A. Robert, Philippos Demetriou, Michael L. Dustin, Michael Meyer-Hermann
F-actin driven CD28-CD80 localization in the Immune Synapse
Cell Reports, 2018
DOI: 10.1016/j.celrep.2018.06.114
Das menschliche Immunsystem ist eine fein ausbalancierte Abwehrmaschinerie, die den Körper vor Krankheitserregern schützt. Verschiedene Immunzellen sind daher ständig auf der Suche nach Fremdmolekülen, die auf einen Krankheitserreger hinweisen, den es zu bekämpfen gilt. Stößt eine dieser Zellen auf einen Fremdkörper, baut sie Teile davon in ihre Oberfläche ein und präsentiert sie anderen Abwehrzellen, den T-Zellen. Dieser Zelltyp ist dafür zuständig, die präsentierten Teile – sogenannte Antigene – als gefährlich oder harmlos einzustufen und bei Bedarf gegen sie vorzugehen. Dazu treten die T-Zellen mit den Antigen-präsentierenden Immunzellen in Kontakt und lesen deren Oberfläche aus. An der Kontaktstelle bilden die beiden Zellen eine ringförmige Struktur aus verschiedenen Proteinen, die immunologische Synapse, über die sie ihre Informationen austauschen. Am Ende dieses Vorgangs wird die T-Zelle entweder aktiviert oder bleibt inaktiv.
Die T-Zelle nimmt Kontakt mit einer Antigen-präsentierenden Zelle mithilfe spezialisierter Adhäsionsmoleküle auf, die zunächst zufällig auf der Zelloberfläche verteilt sind. Das leichte Zusammenkleben der beiden Zelloberflächen ermöglicht die Bindung von Rezeptoren der T-Zelle für die krankheitserregenden Antigene. „Die Entscheidung, ob die T-Zelle aktiviert wird oder nicht, hängt von der Anzahl der erkannten Antigen-Moleküle ab. Die Ausbildung einer vollständig strukturierten Synapse an der Kontaktfläche beeinflusst die Aktivierung“, sagt Anastasios Siokis, Wissenschaftler der HZI-Abteilung „System-Immunologie“ von Prof. Michael Meyer-Hermann, die am Systembiologiezentrum BRICS angesiedelt ist. Bei einer korrekt ausgebildeten immunologischen Synapse konzentrieren sich die Rezeptormoleküle im Zentrum, während sich andere Oberflächenproteine in zwei Ringen darum anordnen.
Wie genau die verschiedenen Moleküle an ihren Platz in der Synapse gelangen, ist bislang nicht vollständig bekannt. „Wir wollten wissen, wie immunologische Synapsen geformt werden“, sagt Anastasios Siokis. „Experimentelle Daten konnten bislang nur zeigen, dass die Antigen-Rezeptoren der T-Zelle von dem Zell-Gerüstprotein Aktin ins Synapsenzentrum transportiert werden. Für die anderen Moleküle ließ sich das aber nicht nachweisen.“ Im Rahmen eines von Meyer-Hermann koordinierten und vom Human Frontier Science Program (HFSP) geförderten Projekts (RGP0033/2015) nutzten die BRICS-Forscher Daten aus Laborexperimenten, die Kooperationspartner der University of Oxford (Großbritannien) im Labor von Michael L. Dustin durchgeführt haben, um die Ausbildung der Synapsen am Computer zu modellieren. Dazu haben sie unterschiedliche Bedingungen und Einflussfaktoren simuliert und konnten zeigen, dass sich die verschiedenen Moleküle in ihrer Anordnung gegenseitig beeinflussen, obwohl sie nicht direkt miteinander interagieren.
„Ein Grund dafür ist die Größe der Zelloberflächenmoleküle: Die Antigen-Rezeptoren sind klein und werden von den großen Adhäsionsmolekülen abgestoßen. Sie organisieren sich in kleinen Clustern, die von Aktin in Richtung des Zentrums der Synapse transportiert werden. Dort blockieren sie den Platz für die anderen Oberflächenmoleküle“, sagt Siokis. „Ein weiteres Molekül, das für die Aktivierung der T-Zelle gebraucht wird, ist ebenfalls klein und bildet einen Ring um die Rezeptoren im Zentrum. Die großen Adhäsionsmoleküle lagern sich in einem äußeren Ring darum an. Das Ringmuster ist also das Ergebnis von mechanischen Kräften in der Zellmembran, die die Moleküle in der Synapse nach der Größe sortiert.“ Die Computer-Simulationen zeigen jedoch, dass sich ohne zusätzliche Krafteinwirkung die Moleküle der beiden inneren Ringe mischen – was allerdings den experimentellen Daten widersprach. „Vergleichende Modellrechnungen ergaben, dass kleine Oberflächenproteine nur unter dem Einfluss von Aktin vollständig in den inneren Ring der Synapse gelangen konnten“, sagt Philippe Robert, ebenfalls Wissenschaftler in der Abteilung „System-Immunologie“. „Unsere Ergebnisse legen nahe, dass nicht nur die Antigen-Rezeptoren an Aktin gekoppelt sind, sondern auch die anderen beteiligten Moleküle, allerdings mit jeweils unterschiedlicher Kopplungsstärke.“
Medizinisch betrachtet sind diese Resultate für die Behandlung einer fehlerhaften T-Zell-Aktivität von Bedeutung. „Die Kenntnis der Mechanismen, die der Ausbildung einer funktionalen immunologischen Synapse zugrunde liegen, ermöglicht es, potenzielle Zielmoleküle für Medikamente zu identifizieren“, sagt Michael Meyer-Hermann. Auf diese Weise könne die Aktivierung von T-Zellen forciert oder gebremst werden, was zu einer verbesserten Bekämpfung von akuten oder chronischen Infektionen, zu größeren Impferfolgen oder zur Verhinderung von Autoimmunerkrankungen eingesetzt werden könnte.
Diese Newsmeldung wurde mit Material idw erstellt.