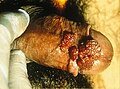
Condylomata acuminata
- Seiten mit Skriptfehlern
- Wikipedia:Vorlagenfehler/Vorlage:Cite journal/temporär
- Wikipedia:Überarbeiten
- Seiten mit defekten Dateilinks
- Virale Infektionskrankheit des Menschen
- Sexuell übertragbare Erkrankung
- Vulva
- Krankheitsbild in der Proktologie
| Klassifikation nach ICD-10 | |
|---|---|
| A63.0 | Anogenitale (venerische) Warzen |
| ICD-10 online (WHO-Version 2019) | |
Bei Condylomata acuminata – auch unter dem Begriff Feigwarzen, Feuchtwarzen und Genitalwarzen bekannte Warzen – handelt es sich um eine Viruserkrankung. Sie sind neben Herpes und Chlamydien eine der häufigsten sexuell übertragbaren Erkrankungen.
Erreger
Feigwarzen werden fast immer durch Niedrigrisikotypen des humanen Papillomvirus verursacht. Die auch Kondyloma-Viren genannten Erreger sind kugelförmige, unbehüllte, doppelsträngige DNA-Viren (dsDNA), die zu den Papillomaviridae gehören, und von denen insgesamt 200 verschiedene (davon ca. 40 anogenitale) Typen bekannt sind. Die anogenitalen HPV-Typen werden in Niedrigrisikotypen (z. B. 6 und 11) und Hochrisikotypen (z. B. 16 und 18) unterschieden. Während eine persistierende Infektion mit Hochrisikotypen das Risiko für bestimmte Krebsformen (v. a. Gebärmutterhalskrebs, in seltenen Fällen aber auch für Peniskarzinom, Analkrebs und Krebs im Mund-Rachen-Raum) erhöht, besitzen Veränderungen durch Niedrigrisikotypen kaum Entartungspotenzial.
Übertragung und Verbreitung
Die Krankheitserreger werden am häufigsten durch Kontaktinfektion beziehungsweise Schmierinfektion beim Geschlechtsverkehr oder Intimkontakt sowie beim Oralverkehr übertragen. Eine Übertragung der Erreger von der Mutter auf das Kind bei der Geburt ist ebenfalls möglich. Bislang nicht eindeutig geklärt ist, ob genitale HP-Viren auch nicht-sexuell übertragen werden können, beispielsweise durch verunreinigte Gegenstände oder gemeinsames Baden. Es gibt allerdings dokumentierte Fälle, bei denen eine sexuelle Übertragung ausgeschlossen werden konnte.[1]
Da sich HPV in erster Linie durch Hautkontakt und nicht durch Körperflüssigkeiten überträgt, bieten Kondome keinen zuverlässigen Schutz. Eine Studie zur Schutzwirkung von Kondomen vor HPV hatte aber zum Ergebnis, dass sich durch konsequenten Kondomgebrauch im Laufe eines Jahres ca. 70 % aller HPV-Infektionen verhindern lassen.[2]
Mehrere Studien zeigen, dass etwa 64 % bis 70 % der männlichen Beziehungspartner von Frauen, die unter einer zervikalen HPV-Erkrankung leiden, ihrerseits HPV-assoziierte Läsionen am Penis aufweisen.[3] HPV kann dennoch auch in der Haut des Penis oft lange unerkannt präsent bleiben.
Etwa 1 % bis 2 % der sexuell aktiven Bevölkerung haben sichtbare Feigwarzen. Darüber hinaus weisen ca. 5 bis 10 % der Bevölkerung subklinische HPV-assoziierte Läsionen im Anogenitalbereich auf, die mit bloßem Auge nicht zu erkennen sind und in der Regel nicht diagnostiziert werden. Bei ca. 60 % der Bevölkerung lassen sich Antikörper gegen HPV im Blut finden, die eine frühere Infektion nachweisen.[4] Das Risiko, im Laufe des Lebens eine HPV-Infektion durchzumachen, wird folglich zwischen 75 % und 80 % beziffert.[5]
Aufgrund der hohen Infektiosität und Verbreitung ist eine HPV-Infektion eine fast zwangsläufige Konsequenz sexueller Kontakte. Fünf Jahre nach Beginn der sexuellen Aktivität haben sich ca. 70 % aller Frauen mit mindestens einem anogenitalen HPV-Typ infiziert.[6]
Krankheitsverlauf/Symptome
Die Mehrzahl der Infektionen verläuft ohne klinische Symptome und ist nach einiger Zeit selbst mit aufwendigen Methoden nicht mehr nachweisbar.
Zwischen der Infektion und dem Auftreten von Feigwarzen kann eine Inkubationszeit von wenigen Wochen, jedoch auch vielen Monaten, selten sogar Jahren liegen. Bei etwa 10 % bis 15 % liegt eine stumme (inapparente) Infektion ohne sichtbare Feigwarzen vor, allerdings können solche Personen mit subklinischen Läsionen auch Virusüberträger sein. Fördernde Faktoren für das tatsächliche Auftreten von Feigwarzen sind ein geschwächtes Immunsystem, Feuchtigkeit, Entzündungen und Hautverletzungen.
Die Krankheitserreger bilden bei Männern und Frauen meist in der Genitalregion oder am After in der Regel kleine Warzen, die jedoch zur Beetbildung neigen und dann konfluierende (sich vereinigende) Warzen ausbilden. Auch intraanale, intravaginale oder urethrale Kondylome sind möglich. Kondylome im Mund sind möglich, aber vergleichsweise selten. Feigwarzen machen sich mitunter durch mehr oder minder starkes Jucken, Brennen oder auch Schmerzen bemerkbar. Häufig verursachen sie aber keine Beschwerden und bleiben daher lange unbemerkt.
Gelegentlich entstehen dagegen sehr große Tumoransammlungen, welche als Condylomata gigantea bezeichnet werden. Diese können unbehandelt auch aufbrechen und stark bluten.[7]
Insgesamt ist diese Erkrankung selbst unbehandelt nicht tödlich, kann jedoch erheblichen negativen Einfluss auf die (sexuelle) Lebensqualität des Patienten erlangen. Condylomata acuminata werden nahezu immer durch Niedrigrisikotypen (in über 90 % der Fälle durch HPV 6 oder 11)[8] verursacht, die nicht als kanzerogen gelten.
In etwa 30 % der Fälle heilen aufgetretene Feigwarzen von selbst wieder ab.
Stark ausgeprägter Feigwarzenbefall in der Vulva
Diagnostik
In der Regel erfolgt aufgrund des charakteristischen Erscheinungsbildes nur eine Blickdiagnose. Bei unklarem klinischen Bild stehen dem behandelnden Arzt weitere diagnostische Maßnahmen offen.
- Essigsäuretest: Eine drei- bzw. fünfprozentige Essigsäure färbt betroffene Areale weißlich. Hierbei können eher unauffällige Zellveränderungen sichtbar gemacht sowie die Ausbreitung besser eingeschätzt werden, falls die Kondylome chirurgisch entfernt werden sollen. Allerdings ist der Essigsäuretest unspezifisch und wenig sensitiv, d. h. sich verfärbende Areale sind nicht zwingend HPV-assoziiert. Falls sich verdächtige Areale nicht verfärben, bedeutet dies aber auch nicht zwingend, dass es sich nicht um Kondylome handelt. Daher kann der Test nur von einem erfahrenen Arzt richtig interpretiert werden.
- Histologische Untersuchung: Eine Gewebeprobe kann im Labor histologisch untersucht werden. Insbesondere Koilozyten gelten als Marker für HPV-assoziierte Hautveränderungen. Es finden sich aber auch zum Teil Hyper- und Parakeratosen.[9]
- Virusnachweis: Der Nachweis von HPV-DNA gehört nicht zu der Routinediagnostik bei Condylomata acuminata. Dennoch ist ein Test per Abstrich von einer verdächtigen Stelle möglich. Als Testmethoden sind Sondentests (weit verbreitet, günstig, differenziert zwischen High und Low Risk) von Tests durch eine Polymerase-Kettenreaktion (teuer, sehr sensitiv, erlaubt die Bestimmung des exakten Virustyps) zu unterscheiden. Die PCR zeichnet sich im Vergleich durch eine deutlich höhere Sensitivität und Spezifität aus.[10]
- HPV-Serologie: HPV-Infektionen verlaufen ohne Virämie. Daher lassen sich die Viren nicht im Blut nachweisen. Der Nachweis von Antikörpern ist wissenschaftlichen Untersuchungen vorbehalten und aufgrund der hohen Durchseuchung ohne diagnostischen Nutzen.
- Durch eine Kolposkopie, Anoskopie, Proktoskopie und bzw. oder Urethroskopie können „innere“ Kondylome ausgeschlossen werden. Vor derartigen Untersuchungen sollten äußere Kondylome entfernt werden, weil ansonsten die Gefahr besteht, die Infektion durch die Untersuchung selbst zu verschleppen.[7]
Differentialdiagnosen
Eine Infektion mit Niedrigrisikotypen wie HPV 6 oder HPV 11 ist von einer Infektion mit HPV 16 und HPV 18 abzugrenzen, da bei Frauen mit einer Infektion der letztgenannten Typen die Gefahr besteht, an Gebärmutterhalskrebs zu erkranken. Differenzialdiagnostisch sind Condylomata acuminata insbesondere von anderen gutartigen Tumoren (z. B. Fibromen), heterotopen Talgdrüsen, Hirsuties papillaris penis, Hirsuties vulvae, Hymenalresten, prämalignen und malignen Veränderungen sowie anderen Infektionen (z. B. Condylomata lata durch Lues) zu unterscheiden.[7] Um die Diagnose abzusichern, kann eine histologische Untersuchung und/oder ein Virusnachweis durchgeführt werden.
Komplikationen
Da HPV häufig in Zusammenhang mit einem erhöhten Krebsrisiko genannt wird, sei darauf hingewiesen, dass eine alleinige Infektion mit Niedrigrisikotypen, die Condylomata acuminata auslösen, das Krebsrisiko in der Regel nicht erhöht. Da Hochrisikotypen aber den identischen Infektionsweg wie Niedrigrisikotypen haben, ist bei Condylomata acuminata eine parallele Infektion mit einem Hochrisikotyp nicht ausgeschlossen. Erste Studien weisen darauf hin, dass Patienten mit Condylomata acuminata eine vergleichsweise hohe Gefahr haben, zusätzlich mit einem Hochrisikotyp infiziert zu sein, weswegen ein routinemäßiger HPV-Test auf Hochrisikotypen (per Abstrich vom Gebärmutterhals) durchaus gerechtfertigt scheint.[11] Falls Hochrisikotypen nachgewiesen werden, ist die Persistenz der Infektion zu überprüfen. In aller Regel kann das Immunsystem die Infektion erfolgreich bekämpfen, so dass sie nach zwei Jahren bei den meisten Frauen nicht mehr nachzuweisen ist. Falls die Infektion mit Hochrisikotypen aber persistiert, erhöht sich deutlich das Risiko, an Gebärmutterhalskrebs zu erkranken.
Größere Kondylome (insbesondere Condylomata gigantea) können den Geburtskanal behindern, was eine Geburt durch Kaiserschnitt notwendig erscheinen lassen kann. Generell kann ein Kaiserschnitt das Risiko einer Übertragung von HPV auf das Kind mindern, aber nicht zuverlässig verhindern.[12]
In seltenen Fällen kann es nach der Übertragung von Niedrigrisikotypen während der Geburt auf das Neugeborene zu einer Larynxpapillomatose kommen.
Behandlung
Ärztliche Eingriffe
Neben der Chirurgische Entfernung ist eine Warzenentfernung mit Laser, Elektrokoagulation, Kauterisierung (Verbrennung mit Kauter) oder Kryotherapie (Vereisung) möglich. Hier wird mit flüssigem Stickstoff oder anderen Vereisungssprays versucht, die Warzen zu entfernen.
Nach der Entfernung kann es zu Schwellungen und Narbenbildung kommen. Sollen Condylome auch am After behandelt werden, besteht die Gefahr, dass der Schließmuskel verletzt wird, so dass er entweder nicht mehr schließen kann oder seine Dehnfunktion verliert, mit der möglichen Folge einer Inkontinenz.
Medikamentöse Behandlung
- Bei einer Kauterisierung durch Verätzung erfolgt eine Behandlung mit den verschiedensten Mitteln wie Salicylsäurelotionen, Trichloressigsäure, Monochloressigsäure oder Silbernitrat. Viele gängige "begrenzt viruzide" Desinfektionsmittel eignen sich nicht zur Desinfektion, da es sich bei HPV um ein unbehülltes Virus handelt.
- Bei einer äußerlichen zytostatischen Behandlung werden Medikamente wie Podophyllotoxin oder 5-Fluoruracil aufgetragen. Die Behandlung mit Podophyllin gilt mittlerweile als obsolet aufgrund von erhöhter Toxizität und des Verdachts karzinogener Effekte.[13] Als Ersatz dafür gibt es heute den aus Podophyllin isolierten und deutlich verträglicheren Hauptwirkstoff Podophyllotoxin in Form einer Salbe (Wartec®) oder einer Lösung (Condylox®) zur Heimanwendung.
- Isotretinoin hat sich in experimenteller Anwendung als effektiv in Fällen von Feigwarzen gezeigt, die durch andere Therapien nicht behandelt werden konnten. Aufgrund der starken Nebenwirkungen von Isotretinoin wird diese Therapie jedoch selten durchgeführt. Es gibt nur wenige Studien über die Anwendung von Isotretinoin bei genital Warzen, und diese Therapie ist derzeit off-label.[14][15]
- Stärkung der Immunabwehr zur Bekämpfung der warzenverursachenden Viren mit Medikamenten wie etwa Interferon, Sinecatechinen (Grünteeextrakte) (Veregen®, VeregenRX™) und Imiquimod (Aldara®) provoziert eine lokal begrenzte Entzündung, regt die lokale Produktion von Antikörpern an und führt zu einer vermehrten Produktion von Interferonen, die tumorhemmend wirken. Im Schnitt ist eine konsequente Therapie mit Aldara® bei jedem zweiten Patienten erfolgreich. Bei Frauen scheint die Creme besser zu wirken als bei Männern. Nach einer erfolgreichen Therapie mit Aldara® ist die Rezidivquote niedriger als bei den anderen derzeit verfügbaren Therapieformen. Daher wird die Creme teilweise auch zur postoperativen Rezidivprophylaxe verschrieben. Polyphenon® E Salbe (Veregen®) hat, ähnlich wie Aldara® eine immunmodulierende Wirkung und erzielte in Zulassungsstudien ähnliche Erfolgquoten mit einer niedrigen Rezidivquote.[16]
Alle genannten Behandlungsmethoden können aufgrund der exponierten Position der betroffenen Körperstellen mit mehr oder weniger schmerzhaften Irritationen einhergehen. Zudem ist die Therapie häufig langwierig und erfordert ein hohes Maß an Disziplin von den Patienten. Die Existenz eines Ping-Pong-Effekts ist umstritten. Konsequenter Kondomgebrauch scheint aber den Heilungsverlauf zu unterstützen.[5] An dieser Stelle sei allerdings nochmals darauf hingewiesen, dass Kondome generell die Infektionsgefahr durch HPV deutlich vermindern, aber dennoch keinen zuverlässigen Schutz bieten.
Bei Immunsuppression
Personen, die mit Medikamenten behandelt werden, welche das Immunsystem unterdrücken sollen (Immunsuppression), wie beispielsweise bei Krebs oder Lupus erythematodes, sind ebenfalls für eine derartige Infektion anfällig. Bei den meisten Patienten treten die Kondylome aufgrund dieser Behandlung auf. Solange die Immunabwehr medikamentös geschwächt werden muss, ist eine Behandlung mehr oder weniger sinnlos, da die Warzen nach kurzer Zeit wieder auftreten.
Trotzdem sollte der Betroffene sich von der Behandlung nicht abschrecken lassen, da die Kondylome ansonsten immer weiter wachsen, sich unkontrolliert vermehren und in den meisten Fällen auch für den Partner ansteckend sind.
Behandlungsmethoden ohne nachgewiesene Wirkung
Neben den schulmedizinisch anerkannten Behandlungsmethoden werden auch alternative Medikamente angeboten. Insbesondere Thuja- oder Teebaumöl werden positive Effekte nachgesagt. Ebenso werden im Internet mehrere pflanzliche Salben und Lösungen angeboten, deren Wirksamkeit niemals in wissenschaftlichen Untersuchungen nachgewiesen wurde.
Ausblick
- Mehrere therapeutische Impfungen gegen HPV befinden sich in frühen klinischen Testphasen. Dabei steht insbesondere die Therapie von Dysplasien, die durch Hochrisikotypen verursacht werden, im Mittelpunkt des Interesses. Allerdings wird auch an therapeutischen Impfstoffen gegen Niedrigrisikotypen, die Condylomata acuminata auslösen, geforscht.[17] Im Gegensatz zu dem einzigen derzeit verfügbaren Impfstoff gegen Feigwarzen (Gardasil®), der die L1-Kapsid-Proteine der HPV-Typen 6, 11 (Low Risk) und 16, 18 (High Risk) enthält und nur prophylaktischen Schutz bietet, enthalten die therapeutischen Impfstoffe zumeist die tumorexprimierten Proteine E1, E2, E6 oder E7 und regen daher das Immunsystem dazu an, bereits infizierte Zellen abzustoßen. Einzige Ausnahme ist die experimentelle therapeutische Impfung gegen Genitalwarzen, welche derzeit in Australien und China erforscht wird (siehe nächster Punkt).
- Derzeit läuft eine klinische Phase-2-Studie an der University of Queensland (Australien) in Zusammenarbeit mit dem Wenzhou Medical College (China), um zu klären, ob eine Immunisierung mit L1 VLPs ohne Adjuvans einen therapeutischen Effekt auf HPV-Infektionen hat. In einer Pilotstudie aus dem Jahr 1999[18] führte die Immunisierung mit L1-VLPs zu einer kompletten Rückbildung der Warzen bei ca. 75 % der Studienteilnehmer innerhalb von 20 Wochen. Daraus schlossen die Wissenschaftler, dass eventuell auch das Protein L1 für eine therapeutische Impfung geeignet ist. Das in Gardasil® verwendete Adjuvans Aluminium scheint aber die für eine therapeutische Wirkung nötigen zytotoxischen Effekte zu verhindern.[19] Die Studie endet im April 2008. Die Ergebnisse werden voraussichtlich gegen Ende des Jahres 2008 veröffentlicht. Eine Markteinführung wäre bei positiven Studienergebnissen frühestens 2012 zu erwarten.[20]
- 2010 wurde eine Phase III Studie zur Wirksamkeit von niedrigdosiertem Cyclophosphamid (7 Tage 50 mg/d) nach erfolgter Laser-Therapie beendet. Es zeigte sich eine komplette Remission und ein Ausbleiben von Rezidiven.[21]
Vorbeugung
Wirksamste Vorbeugung gegen eine Infektion sind Enthaltsamkeit und die Impfung. Safer Sex bietet keinen vollständigen Schutz, verringert die Gefahr einer Ansteckung jedoch deutlich.[22] Der prophylaktische HPV-Impfstoff Gardasil® gegen die HPV-Typen 6, 11, 16 und 18 – von der amerikanischen Arzneimittelbehörde (FDA) in den USA im Juni 2006, von der europäischen Arzneimittelagentur im September 2006 in der EU zugelassen – schützt nach den bislang vorliegenden Untersuchungen zu einhundert Prozent vor einer Infektion mit den genannten Virentypen. Jungen im Alter von 9 bis 15 Jahren entwickelten nach Impfung eine Immunität. Der quadrivalente Impfstoff wurde in einer Studie mit 4.065 Jungen und Männer im Alter von 16 bis 26 Jahren als effektiv beurteilt.[23] Für homosexuelle Männer läuft eine weltweite klinische Studie zur Vorbeugung vor Geschlechtskrankheiten, insbesondere Feigwarzen, ferner Studien mit dem HPV-Impfstoff. Ziel ist eine Schutzimpfung zur Vorbeugung gegen Anal- und Peniskrebs, deren Entstehung ebenfalls mit Infektionen mit HPV in Verbindung gebracht wird. Aufgrund des Übertragungsweges besteht für homosexuelle Männer ein erhöhtes Risiko, ein Analkarzinom zu entwickeln.
Alle HPV-Impfstoffe wirken vorbeugend; eine bereits bestehende HPV-Infektion kann nicht behandelt oder gar beseitigt werden. Ebenso wenig können die späteren Folgen einer solchen Infektion oder ihre Vorstufen mittels einer Impfung behandelt werden. Die Erstimmunisierung sollte daher vor dem ersten Geschlechtsverkehr abgeschlossen sein, da die Impfung offenbar keinen Einfluss auf bereits bestehende Infektionen hat.[24] Eine abschließende Beurteilung der Wirksamkeit sowie der Verträglichkeit ist wie bei allen neuen Medikamenten und Verfahren nicht möglich, Nebenwirkungen scheinen bislang allerdings keine Rolle zu spielen. Unklar ist derzeit, wie lange ein solcher Impfschutz anhalten wird. Bislang wird eine Grundimmunisierung mit drei Impfungen im Abstand von null, zwei und vier bis sechs Monaten empfohlen, Richtlinien zur Impfauffrischung gibt es derzeit nicht, da Langzeitstudien zum Verlauf der Schutzwirkung über die gesamte Lebensspanne gesehen zwangsläufig fehlen. Da die Impfung nicht gegen alle HPV-Typen wirkt, sollten aber auch geimpfte Frauen die Vorsorgeuntersuchungen gegen Gebärmutterhalskrebs (ab 20 Jahren) auf jeden Fall nutzen.
Im Jahre 2011 wurden erste Daten nach Einführung eines flächendeckendes Impfprogramms mit einem quadrivalenten Impfstoff publiziert. Das Programm wurde 2007 in Australien etabliert. Die Impfrate liegt dort bei 80 bis 90 Prozent. Bereits drei Jahre nach Beginn der Impfkampagne sind die behandlungsbedürftigen Krebsvorstufen bei Mädchen unter 18 Jahren um 59 Prozent zurückgegangen.[25][26]
Weblinks
- Leitlinie Condylomata acuminata und andere HPV-assoziierte Krankheitsbilder von Genitale, Anus und Harnröhre der Leitlinien der Deutschen STD-Gesellschaft in Zusammenarbeit mit der Deutschen Dermatologischen Gesellschaft und der Paul-Ehrlich-Gesellschaft. In: AWMF online (Stand Juli 2006)
Einzelnachweise
- ↑ Humane Papillomviren – Ein Risiko für die Gesundheit? (PDF) Informationsblatt des Krebsinformationsdienstes, 16. Januar 2008
- ↑ Condom Use and the Risk of Genital Human Papillomavirus Infection in Young Women. (PDF) In: The new england journal of medicine. 22. Juni 2006, (englisch).
- ↑ Häufige Fragen zu Humanen Papillomviren (HPV) und Gebärmutterhalskrebs. cervical cancer consortium europe
- ↑ arhp.org
- ↑ 5,0 5,1 Humane Papillomviren als Krebsauslöser: Sind die Warzenviren gefährlich? Krebsinformationsdienst, 2. Februar 2009
- ↑ digene.de (PDF)
- ↑ 7,0 7,1 7,2 Condylomata acuminata und andere HPV-assoziierte Krankheitsbilder von Genitale, Anus und Harnröhre. Uni-Düsseldorf, 11. Juli 2006
- ↑ Condylome. Uni München, Patienteninfo.
- ↑ Histologie und Zytologie gut- und bösartiger Veränderungen der Vulva. (PDF) aixcyto.de
- ↑ Papillomavirus (HPV)-Diagnostik. labor-bo.de
- ↑ lbg.ac.at
- ↑ Schwangerschaft und HPV. Medizinische Universität Innsbruck, Arztinformation im Gesundheitsinformationsnetz.
- ↑ Ersatz für Podophyllin-haltige Rezepturen. dermotopics.de, Ausg. 2/2001, Gesellschaft für Dermopharmazie e. V.
- ↑ S. Georgala, A. C. Katoulis, C. Georgala, E. Bozi, A. Mortakis: Oral isotretinoin in the treatment of recalcitrant condylomata acuminata of the cervix: a randomised placebo controlled trial. In: Sex Transm Infect. 80. Jahrgang, Nr. 3, November 2004, S. 216–218, doi:10.1136/sti.2003.006841.
- ↑ Virendra N. Sehgal, Govind Srivastava, Kabir Sardana: Isotretinoin – unapproved indications/uses and dosage: a physician’s reference. In: International Journal of Dermatology. 45. Jahrgang, Nr. 6, Mai 2006, S. 772–777, doi:10.1111/j.1365-4632.2006.02830.x.
- ↑ Veregen®: lokale Salbe aus Grüntee-Extrakt gegen Genitalwarzen (Condylomata acuminata) bei Medknowledge, 2010
- ↑ Warts vaccine: one of many in pipeline. The University of Queensland Australia (englisch)
- ↑ elsevier: HPV6b virus like particles are potent immunogens without adjuvant in man., 6. Januar 2000 (englisch)
- ↑ Website des International RRP ISA Center
- ↑ Protection at a price. australiandoctor.com.au, 26. Oktober 2006 (englisch).
- ↑ CD4+FOXP3+ regulatory T cell depletion by low-dose cyclophosphamide prevents recurrence in patients with large condylomata acuminata after laser therapy. PMID 20338811
- ↑ Zervixkarzinom: Kondome verhindern HPV-Infektionen. ärzteblatt-studieren.de, 22. Juni 2006
- ↑ Anna R. Giuliano et al.: Efficacy of Quadrivalent HPV Vaccine against HPV Infection and Disease in Males. In: N Engl J Med, Nr. 364, 2011, S. 401–411, doi:10.1056/NEJMoa0909537.
- ↑ HPV-Impfung ohne therapeutische Wirkung. ärzteblatt.de, 15. August 2007.
- ↑ Früher Rückgang der Zervixläsionen durch HPV-Impfung. In: Deutsches Ärzteblatt. Nachrichten vom 20. Juni 2011.
- ↑ Julia ML Brotherton, Masha Fridman, Cathryn L May, Genevieve Chappell, A Marion Saville, Dorota M Gertig: Early effect of the HPV vaccination programme on cervical abnormalities in Victoria, Australia: an ecological study. In: Lancet, Nr. 377, 2011, S. 2085–2092, doi:10.1016/S0140-6736(11)60551-5.