Die Zell-Eisenbahn – Erklärungen für Zellbewegungen
Bio-News vom 20.06.2024
Man blickt unter das Mikroskop: Eine Gruppe von Zellen bewegt sich langsam voran, hintereinander wie ein Zug über die Gleise. Dabei navigieren die Zellen durch komplexe Umgebungen. Wie sie das tun und wie sie miteinander interagieren, zeigt nun ein neuer Ansatz von Forschenden. Die experimentellen Beobachtungen und das darauf basierende mathematische Konzept wurden nun veröffentlicht.
Während die meisten Zellen im menschlichen Körper stationär sind, besitzen einige die Fähigkeit zur Migration. Zum Beispiel wandern bei der Wundheilung Zellen durch den Körper, um beschädigtes Gewebe zu erneuern. Dies kann einzeln oder in Gruppen geschehen, deren Größe variiert. Die Interaktion der Zellen auf ihrer Wanderung und ihre gemeinsame Bewegung in der komplexen Umgebung des Körpers sind noch nicht vollständig verstanden. Ein interdisziplinäres Team aus theoretischen Physikern des Institute of Science and Technology Austria und Experimentalwissenschaftlern der Universität Mons in Belgien hat dazu neue Erkenntnisse erlangt.
Forscher haben das Migrationsverhalten einer kleinen Gruppe von Zellen in vitro in genau definierten Umgebungen untersucht – außerhalb eines lebenden Organismus, in einer ausgestatteten Petrischale. Inspiriert von sozialdynamischen Experimenten, bestätigte sich die Annahme: Je kleiner die Gruppe, desto einfacher ist es, die Interaktionen zu verstehen, sowohl bei Menschen als auch bei Zellen.
Publikation:
E. Vercurysse, D. Brückner, M. Gómez-González, A. Remson, M. Luciano, Y. Kalukula, L. Rossetti, X. Trepat, E. Hannezo & S. Gabriele
Geometry-driven migration efficiency of autonomous epithelial cell clusters
Nature Physics (2024)
DOI: https://doi.org/10.1038/s41567-024-02532-x
Zellen reisen in Zügen
David Brückner läuft zurück in sein Büro und schnappt sich seinen Laptop. „Es ist besser, wenn wir ein paar Videos von unseren Experimenten zeigen“, sagt er begeistert und drückt Play.
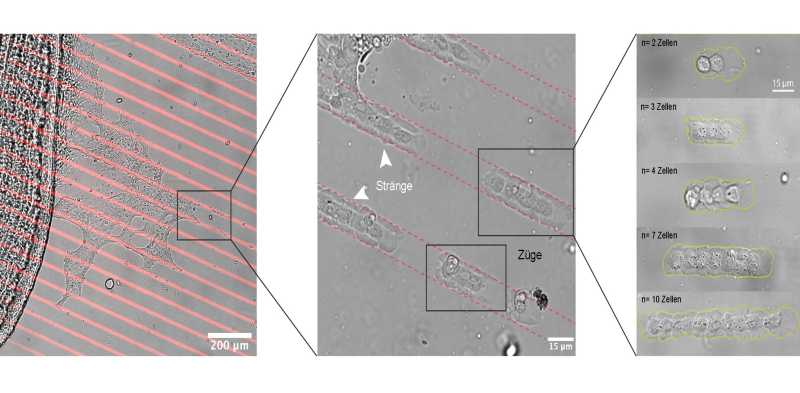
Das Video präsentiert eine Petrischale, auf deren Substrat Microstrips – eindimensionale Bahnen zur Lenkung der Zellbewegung – gedruckt sind. Neben dieser befindet sich eine Zebrafischschuppe, bestehend aus vielen Zellen. Spezialisierte Wundheilungszellen, die sogenannten „Keratozyten“, strecken sich wie Tentakel von der Schuppe aus in die Bahnen hinein. „Durch Klebemoleküle auf ihrer Oberfläche haften die Zellen zunächst aneinander. Sie halten quasi Händchen“, erklärt Brückner. Plötzlich reißt die Verbindung ab. Die Zellen formieren sich zu winzigen Gruppen, die sich fortan wie Züge auf Gleisen vorwärtsbewegen. „Die Länge des Zuges ist immer unterschiedlich. Manchmal besteht er aus zwei-, manchmal aus zehn Zellen. Das ist abhängig von den Ausgangsbedingungen.“
Eléonore Vercurysse und Sylvain Gabriele von der Universität Mons in Belgien haben dieses Phänomen beobachtet, während sie die Wundheilungseigenschaften von Keratozyten in verschiedenen geometrischen Mustern untersuchten. Zur Interpretation dieser rätselhaften Beobachtungen konsultierten sie die theoretischen Physiker David Brückner und Edouard Hannezo am IST Austria.
Brückner und Hannezo begannen mit einem Brainstorming an einer Tafel. Die Wissenschaftler erarbeiteten ein mathematisches Modell, das Zellpolarität, Interaktionen und die Geometrie der Umgebung integriert. Dieses Modell setzten sie dann in Computersimulationen um, um unterschiedliche Szenarien darzustellen.
Zuerst analysierten die Forscher in Klosterneuburg die Geschwindigkeit der Zellzüge. Die Simulation zeigte, dass die Geschwindigkeit der Züge nicht von ihrer Länge abhängt; es macht also keinen Unterschied, ob sie aus zwei oder zehn Zellen zusammengesetzt sind. „Man stelle sich vor, die erste Zelle würde die ganze Arbeit machen und die anderen hinter sich herziehen; die Gesamtgeschwindigkeit würde sinken“, erklärt Hannezo. „Das ist aber nicht der Fall. Innerhalb der Züge sind alle Zellen in die gleiche Richtung gepolt. Sie sind perfekt in dieselbe Richtung ausgerichtet und synchronisiert, und fahren deshalb reibungslos vorwärts.“ In anderen Worten: Die Züge besitzen gewissermaßen Allrad- und nicht nur Vorderrad-Antrieb.
In einem weiteren Schritt erweiterten die Theoretiker in ihren Simulationen die Breite der Fahrspuren und Zellcluster. Im Vergleich zu einzeln bewegenden Zellen waren die Cluster deutlich langsamer. Die Begründung hierfür ist ziemlich einfach: Wenn mehr Zellen sich vereinen, kommt es zu vermehrten Kollisionen. Diese Zusammenstöße bewirken, dass sie sich gegenseitig abstoßen und in entgegengesetzte Richtungen bewegen. Die Zellen sind nicht korrekt ausgerichtet, was den Bewegungsfluss behindert und die Gesamtgeschwindigkeit stark reduziert. Dieses Phänomen konnte auch in belgischen Laboren beobachtet werden (bei in vitro Experimenten).
Sackgasse? Kein Problem für Zellcluster
In Bezug auf Effizienz mag es nicht ideal erscheinen, sich in Clustern fortzubewegen. Jedoch offenbart das Modell, dass es durchaus vorteilhaft sein kann, Cluster oder Haufen zu formen, insbesondere wenn Zellen sich durch eine komplexe Umgebung bewegen, wie es im menschlichen Körper der Fall ist. In den Experimenten und Simulationen konfrontierten die Wissenschaftlerinnen und Wissenschaftler die Zellen mit einer Sackgasse. „Die Zellzüge erreichen das Ende der Sackgasse schnell, taten sich aber schwer, dort die Richtung zu ändern. Da ihre Polarisation nach vorne ausgerichtet ist, konnten sie sich nicht auf einen Richtungswechsel einigen“, so Brückner. „Im Cluster hingegen sind bereits einige Zellen in die andere Richtung polarisiert, was den Richtungswechsel einfacher macht.“
Züge oder Cluster?
Die Frage ist, wann sich Zellen in Clustern und wann in Zügen bewegen. Beide Bewegungsformen sind in der Natur zu beobachten. Manche Entwicklungsprozesse basieren auf Zellclustern, die sich von einer Stelle zur anderen verlagern, während andere Prozesse auf mehreren kleinen Zellzügen beruhen, die sich eigenständig fortbewegen. „Unser Modell lässt sich nicht nur auf einen einzigen Prozess anwenden. Vielmehr handelt es sich um einen breit anwendbaren Rahmen, der zeigt, wie lehrreich es ist, wenn man Zellen in eine Umgebung mit geometrischen Beschränkungen bringt. Das stellt sie vor Herausforderungen und lässt uns ihre Interaktionen entschlüsseln“, fügt Hannezo hinzu.
Ein kleiner Zug vollgepackt mit Informationen
Neueste Veröffentlichungen der Hannezo-Gruppe deuten darauf hin, dass sich Zellkommunikation in Wellenform ausbreitet, als ein Zusammenspiel von biochemischen Signalen, physischem Verhalten und Bewegung. Das kürzlich vorgestellte Modell der Wissenschaftler bietet eine physikalische Basis für diese Zellinteraktionen, die möglicherweise zum Verständnis des größeren Zusammenhangs beitragen könnten. Mit diesem Modell kann das Forschungsteam nun die molekularen Bestandteile dieses Prozesses detaillierter untersuchen. Brückner zufolge ermöglichen es diese kleinen Zellzüge, große Bewegungsmuster – wie die eines ganzen Gewebes – zu verstehen.
Projektförderung
Der ISTA-Teil des Projekts wurde durch Mittel des European Research Council unter dem European Union’s Horizon 2020 Research and Innovation Programme (Grant Agreement No. 851288), durch die NOMIS-Stiftung und die European Molecular Biology Organization (Postdoctoral Fellowship ALTF 343-2022) finanziell unterstützt.
Diese Newsmeldung wurde mit Material Institutse of Science and Technology Austria via Informationsdienst Wissenschaft erstellt.