Neue Erkenntnisse zur Entwicklung der Gehirnstruktur
Bio-News vom 09.10.2019
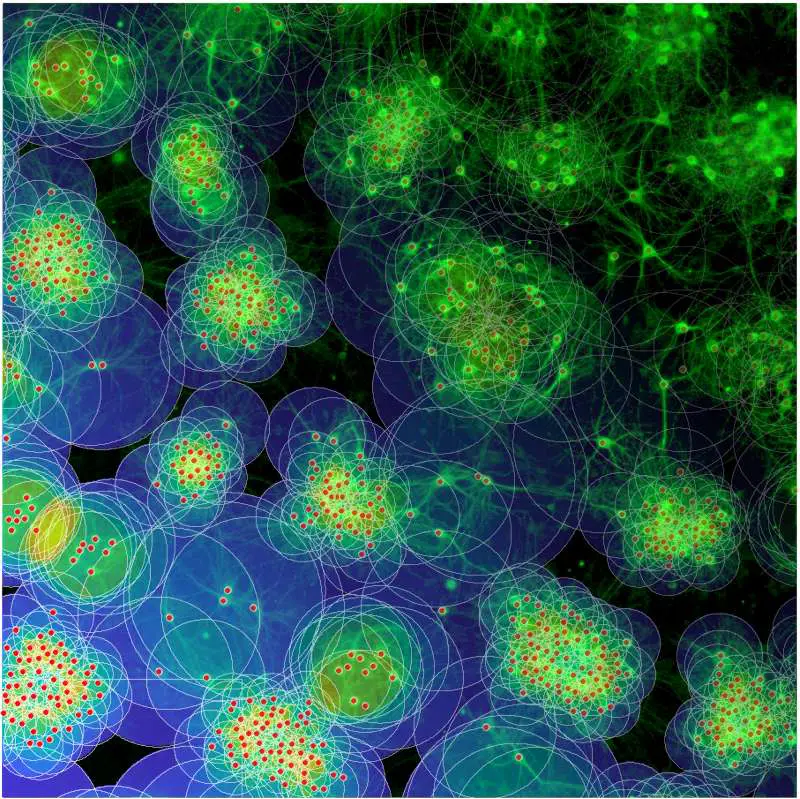
Die Nervenzellen im menschlichen Gehirn sind nicht zufällig angeordnet. In der Großhirnrinde bilden sie Gruppen stark vernetzter Neurone, so genannte Cluster. Diese wiederum stehen untereinander in schwächerem Kontakt. Diese modulare Vernetzungsstruktur, in der neuronale Cluster als spätere Funktionseinheiten angelegt werden, entsteht in einer frühen Phase der Entwicklung. Die zugrunde liegende Selbstorganisation wird von neuronaler Aktivität gesteuert – doch wie die Mechanismen im Detail funktionieren, ist bislang noch weitgehend unbekannt.
Mit simulierten Netzwerkmodellen und in-vitro-Experimenten haben die Neurowissenschaftler Dr. Samora Okujeni und Prof. Dr. Ulrich Egert vom Bernstein Center der Universität Freiburg einen Beitrag zum Verständnis der Gehirnstruktur und ihrer Entwicklung vorgelegt: In ihrer Studie zeigen sie, dass das Zusammenspiel von aktivitätsabhängigem Wachstum von Zellfortsätzen und die Wanderung von Nervenzellen während der Entwicklung eines Netzwerkes in hohem Maß dessen späteren Grad an Modularität beeinflusst. Die Ergebnisse der Arbeit sind im Online-Fachjournal „eLife“ erschienen.
Publikation:
Okujeni, S., Egert, U.
Self-organization of modular network architecture by activity-dependent neuronal migration and outgrowth
Elife 8
DOI: 10.7554/eLife.47996
Neurone sind gesellige Zellen, die auf lange Sicht in Isolation absterben. Sie bilden deshalb während der Entwicklung Fortsätze – so genannte Neuriten – aus, um mit anderen Neuronen über synaptische Verbindungen zu kommunizieren. Sobald sie ausreichend oder zu viele synaptische Eingänge erhalten, hört das Wachstum der Neuriten auf, oder sie werden gekürzt. Dies verhindert, dass Neurone über längere Zeit zu stark aktiviert werden. Forscherinnen und Forscher gehen davon aus, dass neuronales Wachstum auf diese Weise kontrolliert wird, um ein Netzwerk auf einem bestimmten Aktivitätsniveau stabil zu halten. Um die Chancen für Vernetzung zu erhöhen, können Nervenzellen jedoch nicht nur Neuriten bilden, sondern auch in Richtung anderer Neuronen wandern.
„Mit Computersimulationen belegen wir, dass das Wachstum von Neuriten und die Migration von Zellen beim Entstehen spezifischer Netzwerkarchitekturen interagieren“, sagt Okujeni. Dieses Zusammenspiel steuere das Verhältnis zwischen lokaler Vernetzung kurzer Reichweite und globaler Vernetzung langer Reichweite über Cluster hinweg und bestimme damit auch den Grad an Modularität im neuronalen Netzwerk. „Dies wiederum beeinflusst die spontane Aktivität von Nervennetzen und deren Ausbreitungsmuster.“ Diese Zusammenhänge könnten für die gesunde Entwicklung der Großhirnrinde entscheidend sein.
Die Ergebnisse aus der Simulation überprüften die Forscher auch experimentell. Sie untersuchten, wie Zellmigration, Neuritenwachstum und neuronale Aktivität in vitro interagieren. Dazu nutzten sie Nervenzellen aus der Großhirnrinde der Ratte, die auch in Zellkulturen derartige Netzwerkstrukturen ausbilden. Um den Einfluss von Zellmigration auf die Netzwerkentwicklung zu untersuchen, manipulierten die Forscher ein Enzym, das in Nervenzellen die Stabilität und den Umbau des Zellskeletts reguliert. Wie in den Simulationen verstärkte Zellmigration auch in vitro die modulare Vernetzung durch Clusterbildung.
Das Clustern förderte jedoch auch die Entstehung spontaner Aktivität und führte zu insgesamt höheren Aktivitätsniveaus. Dies stand zunächst im Gegensatz zu der Annahme, dass die Aktivität auf einem bestimmten Zielniveau bleibe. Die Forscher konnten diesen Widerspruch auflösen: „Die Aktionspotenzialaktivität steuert die Dynamik des Zellskeletts nicht direkt, sondern indirekt über einen Kalziumeinstrom, der die Balance zwischen Auf- und Abbauprozessen beeinflusst“, erläutert Okujeni. „Modularität erhöht zwar die Rate, mit der Aktionspotenziale generiert werden, reduziert aber gleichzeitig die Synchronisation des Netzwerkes, die wiederum den Kalziumeinstrom pro Aktionspotenzial bestimmt. Auf diese Weise stellt sich nach unseren Schätzungen für alle Netzwerkstrukturen ein ähnliches Zielniveau ein.“
Diese Newsmeldung wurde mit Material der Albert-Ludwigs-Universität Freiburg im Breisgau via Informationsdienst Wissenschaft erstellt.