Osteochondrosis dissecans
- Seiten mit Skriptfehlern
- Wikipedia:Vorlagenfehler/Vorlage:Literatur/Parameterfehler
- Aseptische Knochennekrose
- Hundekrankheit
| Klassifikation nach ICD-10 | |
|---|---|
| M93.2 | Osteochondrosis dissecans |
| ICD-10 online (WHO-Version 2019) | |

Die Osteochondrosis dissecans (OCD, auch angloamerikanisch Osteochondritis dissecans) ist die umschriebene aseptische Knochennekrose unterhalb des Gelenkknorpels, die mit der Abstoßung des betroffenen Knochenareals mit dem darüberliegenden Knorpel als freier Gelenkkörper (Gelenkmaus) enden kann. Es verbleibt dann ein Gelenkflächendefekt (Mausbett). Die OCD kann die meisten Gelenke des menschlichen Körpers betreffen, sie tritt aber vor allem im Kniegelenk, im oberen Sprunggelenk und im Ellbogengelenk auf. Dieser Artikel orientiert sich vor allem an der Lokalisation Knie. Es sind aufgrund mechanischer Gesetzmäßigkeiten ausschließlich konvexe Gelenkflächen betroffen. In der Veterinärmedizin kommt sie insbesondere bei großen Hunderassen (Schulter, Ellbogen, Knie, Sprunggelenk etc.) und bei Mastschweinen vor.
Ätiologie (Ursache)
Von unterschiedlichen, in der Vergangenheit kontrovers diskutierten Entstehungstheorien scheinen mechanische Faktoren (repetitive Impulsbelastungen) die wahrscheinlichste Ursache darzustellen. Daher sind auch aktive bis hochaktive Kinder und Jugendliche am häufigsten betroffen. Möglicherweise spielt bei der (typischen) OCD an der medialen Femurkondyle eine Störung des Bewegungsablaufs beim Rennen eine entscheidende Rolle: Es kommt, wie Bewegungsanalysen zeigen, zu einer kurzfristigen Rotation im Knie mit folgendem Anschlagen der Femurkondyle an die Wange der Eminentia intercondylaris. Bei der selteneren Osteochondrosis dissecans der lateralen Femurkondyle spielt oft eine Meniskuspathologie (z.B. ein Scheibenmeniskus) und möglicherweise auch kindliches Rheuma eine Rolle. Bei der ebenfalls häufigen OCD der medialen Talusschulter und der zentralen Talusrolle im oberen Sprunggelenk handelt es sich um eine echte OCD mit sportbedingter repetitiver Überlastung. Bei der Knorpelknochenläsion der lateralen (äußeren) Talusschulter handelt es sich ausschließlich um die Folge wiederholter Umknickverletzungen, damit also um traumatische osteochondrale Flakes, Knorpel-Knochenschuppen mit völlig anderem Therapieansatz. Bei der OCD am Ellenbogen sind armbelastende Wurfsportarten (Handball, Volleyball) ursächlich beteiligt. Aber nicht bei allen OCD-Formen lässt sich die mechanische Genese so zweifelsfrei wie am Knie dokumentieren. Welche Rolle die Knochenstruktur und -qualität bei der Entstehung der OCD spielt, ist Gegenstand weiterer Untersuchungen der Osteologie. So findet sich bei fast allen Betroffenen ein z.T. ausgeprägter Vitamin D3-Mangel mit entsprechenden Störungen des Calcium-Stoffwechsels.
Pathogenese (Krankheitsverlauf)
Die Erkrankung entsteht auf dem Boden einer knöchernen Strukturstörung unterhalb des Knorpels (subchondrale Vaskularisationsstörung). Am Anfang kommt es in diesem Bereich zu einer Osteonekrose, später zu einer bindegewebigen Demarkation (Abstoßung) gegenüber dem vitalen umgebenden Knochen. Der dem Osteochondroseherd aufliegende Gelenkknorpel zeigt anfänglich keinerlei Veränderungen, er ist vital und mechanisch stabil, weil seine (normale) Ernährung durch die Gelenkflüssigkeit Synovia sichergestellt ist. Später kommt es aufgrund der instabiler werdenden knöchernen Unterlage und einer Volumenzunahme im Grenzbereich zwischen Dissekat und Lagerknochen zu sekundären Knorpelveränderungen in Form von Überdehnungen und Einrissen. Diese Konturveränderungen der effektiven Gelenkoberfläche kann durch Einklemmung (Impingement) nun erstmalig zu intermittierenden Blockaden führen. Unter fortlaufender Beanspruchung kommt es dann zu einer Lockerung des toten Knochens aus der vitalen Umgebung und nach Riss der elastischen Knorpeldecke in der Spätphase zu einer Lösung des gesamten Knorpel-Knochenstücks und damit zur Gelenkmaus (Dissekat). Das Dissekat kann dann lange im Mausbett verbleiben (häufig im Talus) oder akut dislozieren (öfter an der Femurkondyle), d.h. durch Gelenkbewegung in andere Teile der Gelenkhöhle verschoben werden. Dieses Stadium gibt der Erkrankung den Namen (dissecans): Früher, vor Röntgen und Kernspin-Untersuchung, wurde die Krankheit erst durch die Ablösung der „Maus" und die dadurch ausgelöste Blockierung erkannt. Im letzten Stadium der Erkrankung (der Dissektion) kann das Knorpel-Knochenfragment sich auch zerlegen und in kaum nachweisbare Teile zerfallen. Es verbleibt auf jeden Fall bei der Dissektion ein relevanter, der Mausgröße entsprechender Gelenkflächendefekt (Mausbett)
Klinik (Beschwerden)
Erste Beschwerden treten als unspezifische belastungsabhängige Schmerzen am betroffenen Gelenk auf. Diese werden bei Kindern als Verletzungsfolgen (welches Kind stößt sich nicht mal beim Sport?), Wachstumsschmerzen (welches Kind wächst nicht?) oder als Rheuma fehlinterpretiert. Die Dauer von den ersten Beschwerden bis zur definitiven Diagnosestellung beträgt heute immer noch etwa 1 Jahr. Morgendliche Beschwerden kommen nicht vor, eher treten sie während oder nach sportlicher Aktivität auf. Typischerweise muß der Sport aufgrund der Schmerzen bei schon längerem Verlauf eingestellt werden. Konsequente Sportpause oder Entlastung mindert die Beschwerden. Ein Gelenkerguss (dickes Knie) oder eine Weichteilschwellung gehört nicht zu den Zeichen der OCD. Nach Ablösen einer Gelenkmaus kann diese einklemmen und es kommt zur Gelenksperre (Blockierung) und plötzlich einsetzenden heftigen Schmerzen wie bei einem großen Meniskusriss. Mechanische Symptome (Blockaden, Streckhemmung) zusätzlich zu Schmerzen sind immer ein Warnsignal und ein Hinweis auf eine Gelenkflächenveränderung, eine Instabilität oder auf eine beginnende Dissektion des Knorpel-Knochen-Fragmentes.
Diagnose
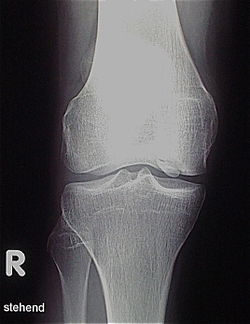
Oft wird die Erkrankung zufällig auf einem Röntgenbild entdeckt, das nach einem Unfall von der Knieregion, vom Sprunggelenk oder vom Ellbogen angefertigt wird. Bei Beschwerden typischer Art bei aktiven Kindern und Jugendlichen kann mit einem einfachen Röntgenbild die eindeutige Diagnose gestellt werden, weil der abgestorbene Knochen unterhalb der Gelenkoberfläche an typischer Stelle an der Femurkondyle identifiziert werden kann. Manchmal kann eine sogenannte Tunnelaufnahme mit gebeugtem Knie die Nekrosezone noch besser zeigen. Zur genaueren Analyse muss in den meisten Fällen eine Kernspintomographie durchgeführt werden. An den dabei erzeugten Bildern lässt sich die Lage und Größe des Befundes, die Tiefenausdehnung und vor allem eine Beteiligung des darüberliegenden Knorpels genau ausmessen. Es sind auch Aussagen zur Stabilität des Befundes zu treffen. Daraus ergeben sich dann therapeutische Konsequenzen. Für die Verlaufsbeurteilung der Erkrankung eignet sich besonders die MR-Untersuchung, aber auch wieder die einfache Röntgenuntersuchung.
Therapie
Die Therapie der Osteochondrosis dissecans ist abhängig von der relativen Größe der Veränderungen und von der Lokalisation in Bezug zum Gelenk. Es gibt OCD an der medialen und an der lateralen Oberschenkelrolle (Kondyle). Selten kommt die Veränderung auch am Gleitlager gegenüber der Kniescheibe und an der Kniescheibe selber vor. Ein weiteres wichtiges Entscheidungskriterium ist das Stadium (stabil / instabil) der Läsion. Als Instabilitätszeichen tritt im MR eine Zystenbildung, eine Vorwölbung des Dissekates und eine Rissbildung im Knorpel deutlich hervor. Ein wichtiges klinisches Zeichen für eine Instabilität sind Blockierungen in der Gelenkfunktion, die als Zeichen der Beteiligung der Gelenkoberfläche an dem Erkrankungsprozess auftreten. Zusätzlich spielt das Alter des Patienten eine gewisse Rolle. Bei noch weit offenen Wachstumsfugen, also bei Jungen bis zum 14. bei Mädchen bis zum 13. LJ sind die spontanen Heilungsaussichten etwas besser. Im Durchschnitt heilen 50 % der OD-Fälle am Kniegelenk ohne operative Maßnahmen aus. Die Ausheilung dauert immer Monate bis Jahre, weil der Knochenumbau (Remodeling) der Nekrosezone durch Osteoklasten und Osteoblasten lange Zeit in Anspruch nimmt.
Konservative Therapie
Zunächst sollte immer, außer bei dissezierten oder dissektionsgefährdeten (instabilen) Befunden, ein konservativer Versuch ohne Operation gemacht werden. Hierzu wird die mechanische Beanspruchung des betreffenden Gelenkes massiv reduziert durch ein konsequentes Sportverbot. Bei nachhaltigen Beschwerden kann auch eine Entlastung an Unterarmgehstützen bei Läsionen am Knie oder am Sprunggelenk bis zum Abklingen der Schmerzen notwendig werden. Ruhigstellungen von Gelenken z.B. im Gipsverband oder Entlastungen mit z.B. einer Thomasschiene finden bei aktuellen Behandlungskonzepten keine Anwendung mehr.
Operative Therapie
Bei anhaltenden oder trotz konsequenter Sportpause zunehmenden Beschwerden am Knie oder Sprunggelenk, besonders bei Neuauftreten von mechanischen Symptomen wie Blockierungen oder Gelenkschnappen und bei Größenzunahme oder Instabilitätshinweisen im MR ist eine Gelenkspiegelung (Arthroskopie) des betreffenden Gelenkes empfohlen, um den Zustand des Gelenkknorpels beurteilen zu können, was mit der Kernspintomographie nicht zuverlässig gelingt. Harte Kriterien für eine Operation sind ein sehr großer Herd oder Instabilitätszeichen.
Ist bei der arthroskopischen Diagnostik der Knorpel intakt und gelenkseitig noch keine Abgrenzung des betroffenen Bereichs zu erkennen, ist eine retrograde (von außerhalb des Gelenkes) Anbohrung der Sklerosezone zur Revitalisierung des Knochens indiziert. Hierzu werden spezielle kanülierte Bohrer verwendet, bei denen mit einem Führungsdraht zunächst die korrekte Lage kontrolliert und dann definitiv überbohrt wird. Durch die Bohrlöcher können Gefäße und Stammzellen in den nekrotischen Bereich eindringen und den Knochen regenerieren. Die Lage der Bohrkanäle wird während der Operation auch mit Hilfe einer Röntgen-Durchleuchtung kontrolliert.
Ist der betroffene Bereich noch nicht gelöst, der Knorpel intakt, aber eine beginnende Abgrenzung erkennbar, kann man durch einen Bohrkanal eine retrograde Spongiosaplastik oder durch den abgehobenen Befund (Knorpel-Knochen-Deckel) eine offene Knochentransplantation und Bohrung durchführen. Dieses Verfahren findet besonders bei den hartnäckigen Befunden am Sprungbein (Talus) Anwendung, die selten spontan ausheilen.
Bei gelockertem oder gelöstem Dissekat ist die Refixierung des Dissekats bei jugendlichen Patienten angezeigt. Hierzu werden resorbierbare Pins oder Schrauben verwendet. Das Dissekat und das „Mausbett" muss dazu angefrischt und mögliche Substanzdefekte mit autologer Spongiosa aufgefüllt werden.Bei zerstörtem oder avitalem Dissekat ist meist bei Erwachsenen eine Knochen-Knorpeltransplantation die Therapie der Wahl. Diese Operationen werden im Gegensatz zu den reinen Anbohrungen offen über eine Gelenkeröffnung durchgeführt. Der Vorteil der Knorpel-Knochentransplantation ist die Verwendbarkeit auch bei tiefen knöchernen Läsionen, wie sie bei OD häufig zu finden sind. Hierbei entstehen allerdings Entnahmedefekte, die aber klinisch meist keine relevanten Beschwerden erzeugen.
Neuere Verfahren der Knorpelzelltransplantation wenden die Transplantation im Labor gezüchteter körpereigener (autologer) Knorpelzellen in die Knorpeldefekte unter einer Schutzschicht aus körpereigener Knochenhaut oder von collagenen Matrixvliesen als autologe Chondrozyten-Transplantation (ACT) oder in Matrixsubstanzen als matrix-assoziierte Chondrozytenimplantation (MACI) an. Erfolgreich ist inzwischen auch die zellfreie Implantation von collagener Matrix in das vorbereitete mikrofrakturierte Defektlager als AMIC (autogene matrixinduzierte Chondrogenese). Vorteilhaft ist hier das Vermeiden der aufwendigen Zellzüchtung mit bekannt nur unvollständiger Differenzierung zu Knorpelzellen. Das Ergebnis einer hyalinähnlichen Regeneration kann über eine solche verbesserte Mikrofraktur erreicht werden. Bei tiefen knöchernen Nekrosezonen sind diese Verfahren der Knorpelregeneration allein allerdings nicht geeignet. Es sollte zusätzlich eine autologe (körpereigene) Spongiosatransplantation unter der Knorpelschicht durchgeführt werden.
Weiterhin versuchen einige Gruppen, mit einer extrakorporalen Stoßwellentherapie das Dissekat wieder zu revitalisieren, sofern es sich noch nicht als Gelenkmaus abgespalten hat. Andere Gruppen versuchen eine hyperbare Sauerstofftherapie. Belege für den Erfolg gibt es bei beiden experimentellen Ansätzen nicht.
Ergebnisse
Das Ziel der Behandlung ist eine vollständige Wiederherstellung der Struktur und Funktion des betroffenen Gelenks. Dazu ist eine Revitalisierung und eine Umstrukturierung (Remodeling) der nekrotischen Knochenareale Voraussetzung. Da Knochen generell völlig narbenfrei und in physiologischer Struktur ausheilen kann und umbaut, sind primär keine anatomischen oder mechanischen Restschäden zu erwarten, solange die knorpelige Gelenkoberfläche nicht betroffen ist. Kleinere und stabile Befunde bei Jugendlichen können sich unter konsequenter Sportpause in frühestens einem Jahr spontan zurückbilden bzw. ausheilen. Bei größeren, ebenfalls stabilen, nicht dissezierten Befunden kann trotz operativer Maßnahmen (Anbohrung) die Heilung mehrere Jahre in Anspruch nehmen. Nach Ausheilung solcher Befunde sind die Ergebnisse meist als sehr gut und gut zu bezeichnen.
Instabile Erkrankungen, bei denen ein osteochondrales Dissekat aus dem Gelenkverbund gefallen ist, ist das Ziel die anatomische Einpassung des Gelenkteils in das „Mausbett" und seine stabile Fixierung. Das Mausbett und das Dissekat werden zunächst mit scharfen Instrumenten von allem lockeren Gewebe befreit, bis die knöcherne Basis erreicht wird. Anschließend wird von der Kontaktfläche weit in den gesunden Knochen gebohrt, um auch hier Gefäßen und Stammzellen das Einwachsen zu ermöglichen. Dann wird der durch die Entfernung des lockeren Gewebes entstandene Knochendefekt durch ein Knochentransplantat aufgefüllt. Die Dissekatschuppe wird dann mit resorbierbaren Polymerstiften mechanisch stabil fixiert. Hier können bei optimaler Technik auch gute und zum Teil sehr gute Ergebnisse erreicht werden.
Einbau- und Umbauvorgänge dauern sehr lange (Jahre). Die Belastbarkeit eines solchen betroffenen Gelenks ist für viele Monate deutlich eingeschränkt.
Ebenfalls gute Ergebnisse lassen sich bei dissezierter Osteochondrose mit Verlust oder Zerfall des Dissekates erzielen, wenn eine osteochondrale Transplantation von einem Knorpel-Knochen-Zylinder aus einem wenig belasteten Gelenkareal in den Defektbezirk durchgeführt wird. Ausschließlich autologe Knorpelzelltransplantationen können den knöchernen Defekt nicht ausgleichen und eignen sich daher nicht für tiefgreifende Schäden der Gelenkflächen. Die Ergebnisse von Zelltransplantationen sind daher nur im Zusammenhang mit gleichzeitigen Knochentransplantationen oder durch Verwendung von synthetischen Matrixsubstanzen der osteochondralen Transplantation vergleichbar.
Literatur
- Eric J.Wall, Jason Vourazeris, Gregory D.Myer, Kathleen H. Emery, Jon G. Divine, Todd G. Nick, and Timothy E.Hewett: The Healing Potential of Stable Juvenile Osteochondritis Dissecans Knee Lesions. In: Journal of Bone and Joint Surgery (American Edition). Band 90, Nr. 12. JBJS, Needham, MA 02492-3157 2008, S. 2655–2664, PMID 19047711.
- Meenen NM, Rischke B: Autogene osteochondrale Transplantation (AOT) bei Knorpeldefekten am Femurkondylus. In: Operative Orthopädie und Traumatologie. Band 15, 2003, S. 38–56, doi:10.1007/s00064-003-1061-z.
- Petersen JP, Ruecker A, von Stechow D, Adamietz P, Poertner R, Rueger JM, Meenen NM: Present and future therapies of articular cartilage defects. In: European Journal of Trauma. Band 29, Nr. 1, 2003, S. 1–10, doi:10.1007/s00068-003-1215-6.
- Baumbach K, Petersen JP, Ueblacker P, Schröder J, Göpfert C, Stork A, Rueger JM, Amling M, Meenen NM: The fate of osteochondral grafts after autologous osteochondral transplantation: a one-year follow-up study in a minipig model. In: Arch Orthop Trauma Surg. Band 128, Nr. 11, 2008, S. 1255–1263, PMID 18064477.