Santonin
- Seiten mit Skriptfehlern
- Wikipedia:Vorlagenfehler/Vorlage:Sigma-Aldrich
- Wikipedia:Vorlagenfehler/Vorlage:Infobox Chemikalie
- Wikipedia:Wikidata-Wartung:PubChem fehlt lokal
- Wikipedia:Wikidata-Wartung:DrugBank fehlt lokal
- Gesundheitsschädlicher Stoff bei Verschlucken
- Giftiger Stoff bei Hautkontakt
- Hautreizender Stoff
- Augenreizender Stoff
- Giftiger Stoff bei Einatmen
- Atemwegsreizender Stoff
- Wikipedia:Verwendet aufgehobene P-Sätze
- Wikipedia:Wikidata-Wartung:CAS-Nummer fehlt lokal
- Keton
- Dien
- Cyclohexadien
- Cyclohexan
- Butyrolacton
- Terpen
- Sekundärer Pflanzenstoff
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
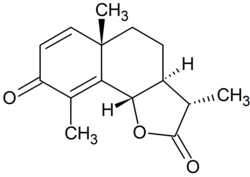
| |||||||
| Allgemeines | |||||||
| Name | Santonin | ||||||
| Andere Namen |
| ||||||
| Summenformel | C15H18O3 | ||||||
| Kurzbeschreibung |
farblose Kristalle, die sich im Licht gelb färben; bitterer Geschmack[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 246,31 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Dichte |
1,19 g·cm−3 [2] | ||||||
| Schmelzpunkt |
174 °C [2] | ||||||
| Siedepunkt |
(sublimiert bei 120 °C) [2] | ||||||
| Löslichkeit |
schwach löslich in heißem Wasser, gut löslich in heißem Ethanol und heißem Diethylether [2] | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Santonin (Santoninsäureanhydrid) ist der wirksame Bestandteil des sogenannten Wurmsamens, aus dem es fabrikmäßig dargestellt wird. Santonin bildet glänzende, weiße, tafelförmige Kristalle aus, die geruchlos und geschmacklos sind, aber in alkoholischer Lösung stark bitter schmecken.
Geschichte
Die Substanz wurde 1830 gleichzeitig von Kahler in Düsseldorf und Joachim August Alms (1803–1847) in Penzlin entdeckt. In den USA war Santonin die erste kommerziell erfolgreiche medizinische Substanz der Firma Pfizer.
Gewinnung und Darstellung
Zur Gewinnung von Santonin kocht man den Wurmsamen (Artemisia cina, Zitwerblüte) mit verdünnter Kalkmilch aus, versetzt die so erhaltene Lösung des santoninsauren Kalkes mit verdünnter Salzsäure, wodurch das Santonin ausgefällt wird, entfernt das gleichzeitig mit abgeschiedene Harz durch Behandlung mit heißem ammoniakalischen Wasser und kristallisiert das noch gefärbte Santonin, nach Behandlung seiner alkoholischen Lösung mit Tierkohle, aus Alkohol um. Die Ausbeute beträgt 1,8 bis 2,3 Prozent.
Eigenschaften
Der Schmelzpunkt liegt bei 174 °C.[2] In Wasser ist das Santonin kaum löslich, gegenüber Lackmus zeigt es keine Wirkung. In chemischer Hinsicht ist es das Lacton der einprotonigen Santoninsäure (C15H20O4) und der Formel C15H18O3 entsprechend.
Durch Kochen von santoninsaurem Barium mit Bariumhydroxidlösung entsteht eine neue, aber isomere Säure, die Santonsäure. Im zerstreuten Tageslicht, schneller im direkten Sonnenlicht, färbt sich das Santonin gelb und muss daher in schwarzen Gläsern im Dunkeln aufbewahrt werden. Seine Säure, die Santoninsäure, erleidet dagegen im Sonnenlicht keine Farbveränderung.
Verwendung
Das Santonin wie auch das santoninsaure Natrium wurde früher gegen Spulwürmer verwendet, wird aber wegen seiner Toxizität nicht mehr eingesetzt. Bereits das 2-3fache der Tagesdosis (100 mg für Erwachsene) kann Vergiftungserscheinungen hervorrufen, die sich zunächst in Violett- dann Gelbsehen äußern; weiterhin können Krämpfe und Durchfall auftreten.[4][1] Schädigungen des Sehnervs wurden aber auch nach längerer Einnahme therapeutischer Dosen beobachtet.[5]
Einzelnachweise
- ↑ 1,0 1,1 Römpp CD 2006, Georg Thieme Verlag 2006.
- ↑ 2,0 2,1 2,2 2,3 2,4 Handbook of Chemistry & Physics, 59. Auflage.
- ↑ 3,0 3,1 3,2 3,3 Datenblatt (−)-α-Santonin bei Sigma-Aldrich (PDF).
- ↑ Harry Auterhoff, Lehrbuch der pharmazeutischen Chemie, Wissenschaftliche Verlagsgesellschaft Stuttgart, 1968.
- ↑ Habermehl/Hammann/Krebs/Ternes, Naturstoffchemie, 3. Auflage, Springer Verlag 2008, ISBN 978-3-540-73732-2.
Literatur
- Ludmilla Birladeanu: Die Geschichte von Santonin und Santonsäure. Angewandte Chemie 115, S. 1236–1242 (2003), ISSN 0044-8249.