Biologen verändern Form von Hefezellen
Bio-News vom 04.03.2021
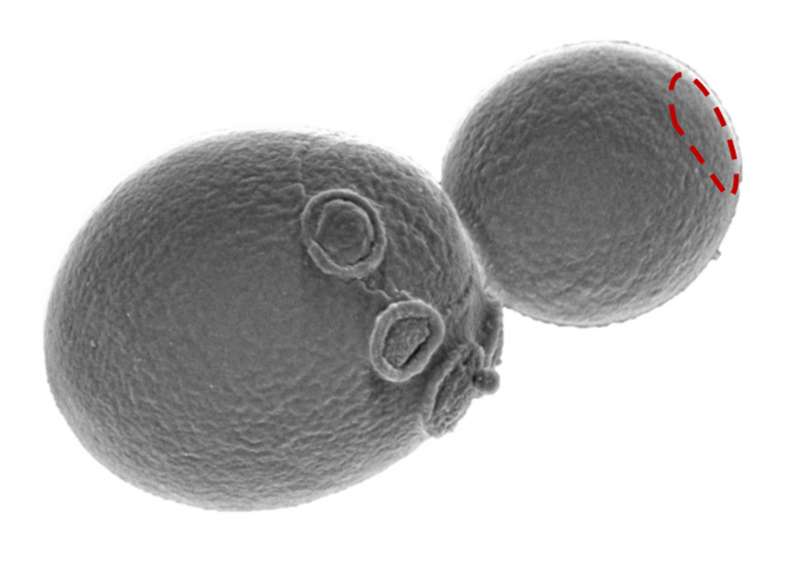
Forschern ist es gelungen, mit Hilfe einer Punktmutation in einem Motor-Protein (Typ V Myosin) die Form von Hefezellen zu verändern. Die Einzeller waren in der mutierten Variante nicht mehr oval, sondern kugelrund.
In ihrer Studie konnten sie außerdem aufklären, welche Rolle das sogenannte Polarisom dabei spielt. Dieser Proteinkomplex bildet eine Art Zielfeld, in dem die Vesikel anlanden, die das Baumaterial für die Bildung von Tochter-Knospen herbeischaffen. Wie die Wissenschaftler nachwiesen, wird die Form und Position des Polarisoms und damit die Grundform der Hefezellen entscheidend von der Wechselwirkung mit dem Motor-Protein geprägt.
Hefepilze sind ganz besondere Einzeller, die dem Menschen beim Brotbacken und Bierbrauen wertvolle Dienste leisten. Sie lieben Zucker und können diesen an der Luft zu Kohlendioxid veratmen oder unter Luftabschluss zu Alkohol umwandeln. Wenn Hefepilze „Hunger“ haben und in ihrer Umgebung nach Nahrung suchen, neigen sie zur Kettenbildung. „Das heißt die Zellen, die sich durch Knospenbildung vermehren, reihen sich in einer Richtung aneinander, um sich einer möglichen Nahrungsquelle anzunähern“, erklärt Professor Nils Johnsson, Leiter des Instituts für Molekulare Genetik und Zellbiologie an der Universität Ulm. Dabei kommt ihnen ihre leicht gestreckte und ovale Form zugute.
Publikation:
Alexander Dünkler, Marcin Leda, Jan-Michael Kromer, Joachim Neller, Thomas Gronemeyer, Andrew B. Goryachev, and Nils Johnsson
Type V Myosin focuses the polarisome and shapes the tip of yeast cells
Journal of Cell Biology, March 3 2021
Der Ulmer Wissenschaftler hat gemeinsam mit Institutskollegen und Zellbiologen aus Edinburgh herausgefunden, welche nanophysikalischen Mechanismen dafür sorgen, dass Hefe-Zellen in ihrer Grundform oval sind. Mit einer gezielten Mutation gelang es den Forschern, die Zellform zu verändern: von oval in kugelrund. Über die Mutation konnten die Wissenschaftler schließlich auf den regulären zellbiologischen Mechanismus schließen, der für die gestreckte Grundform der Hefezelle verantwortlich ist.
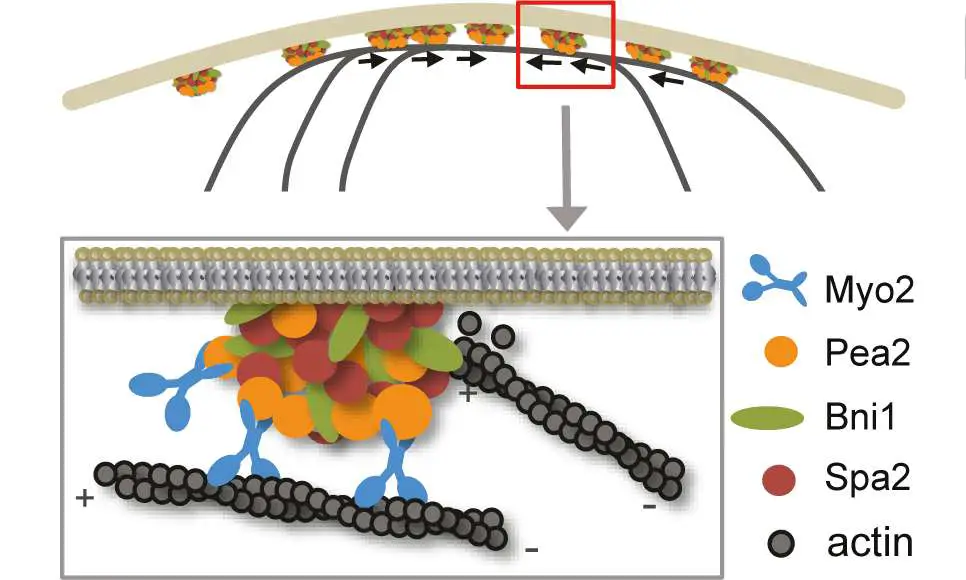
„Hefen sind einzellige Pilze, die sich durch die sogenannte Sprossung vermehren. Das heißt, an der Mutterzelle bildet sich eine Tochter-Knospe. An der Stelle, an der die Tochter-Knospe aussprosst, werden neue Zellwände gebildet, die die neu geborene Hefezelle umschließen. Diese Zell-Teilungs- und Wachstumsprozesse verlaufen am sogenannten Polarisom. Der Begriff bezeichnet ein „quirliges“ Protein-Protein-Interaktionsnetzwerk, das unterhalb der Zellmembran an der Wachstumsspitze der Hefe-Zelle sitzt. Das Polarisom bildet das Zielfeld für Vesikel, die neues Material für das Wachstum der äußeren Zellwand und der inneren Zellmembran liefern.
„Ist das Zielfeld kompakt und stabil wie eine Kappe, wächst die Zelle an diesem Punkt gerichtet in die Länge“, erläutert Dr. Alexander Dünkler. Der Erstautor der im Fachmagazin „Journal of Cell Biology“ veröffentlichten Studie ist Postdoktorand an Johnssons Institut.
Für ihre Hefe-Studie hat das Forscherteam eine Punktmutation in das Genom der Hefe eingeführt, die dafür sorgt, dass die von ihnen entdeckte Verbindung zwischen Motorprotein (Typ V Myosin) und Polarisom getrennt wird. Als Folge ist das Polarisom über die gesamte Membran der sprossenden Hefezelle verteilt, und die Knospe wächst gleichmäßig rund. „Das bedeutet im Umkehrschluss, dass die Interaktion mit dem Motorprotein eine Schlüsselrolle bei der intrazellulären Selbstorganisation des Polarisoms spielt und damit letztendlich auch die Zellform entscheidend beeinflussen kann“, so Dünkler.
Die subzellulären Mechanismen dieser Interaktion beschreiben die Wissenschaftler so: Motorproteine bewegen die sogenannten Polarisom-Nanokomplexe entlang von Aktinfilamenten – wie auf Schienen – hin- und her, bis die perfekte „Park-Position“ unterhalb der Membran gefunden ist. Das Erstaunliche: jeder Polarisom-Nanokomplex hat selbst auch die Fähigkeit, Aktinfilamente zu bilden, auf denen ein weiterer Polarisom-Nanokomplex ankoppeln kann. Über diesen Verstärkungsmechanismus entwickelt sich eine Dynamik, die dazu führt, dass die kompakte Struktur des Polarisoms gleichzeitig stabil und anpassungsfähig bleibt.
Um die Nanomechanismen zu aufzuklären, die für diese intrazellulären Prozesse und Mikrostrukturen verantwortlich sind, haben die Ulmer Wissenschaftler mit der Hilfe von Professor Andrew B. Goryachev, Systembiologe an der Universität Edinburgh, ein biophysikalisches Modell entwickelt und am Computer realisiert. Die daraus abgeleiteten Vorhersagen konnten schließlich experimentell bestätigt werden. „Der von uns beschriebene Mechanismus zur Selbstorganisation eines Proteinnetzwerks sollte recht generell sein. Das heißt, er gilt auch für ganz ähnliche Proteinkomplexe, die als Zielfelder für Transport-Vesikel in anderen Organismen fungieren“, sind sich die Wissenschaftler aus Ulm und Edinburgh sicher. Gefördert wurde dieses Projekt zur zellbiologischen Grundlagenforschung von der Deutschen Forschungsgemeinschaft (DFG).
Diese Newsmeldung wurde mit Material der Universität Ulm via Informationsdienst Wissenschaft erstellt.