Model der Autobahnen im Gehirn entwickelt
Bio-News vom 08.05.2024
Unser menschliches Gehirn ist nicht nur größer und enthält mehr Nervenzellen als die Gehirne anderer Arten, sondern ist auf eine ganz besondere Weise vernetzt: Dicke Nervenbündel verbinden Gehirnregionen über weite Strecken, etwa die linke und die rechte Gehirnhälfte. Ein Forschungsteam präsentierte nun das erste Organoidmodell, in dem diese Informations-Autobahnen untersucht werden können.
Unser Gehirn ähnelt dem Straßennetz: Wie Landstraßen vernetzen kleine Verbindungen benachbarte Nervenzellen, während dicke Nervenbündel wie Autobahnen die verschiedenen Regionen des Gehirns verbinden. Diese dicken, stark genutzten Nervenbündel, die zum Beispiel die linke und rechte Gehirnhälfte und die Vorder- und Rückseite des Gehirns verbinden, konnten bisher nicht experimentell untersucht werden.
Publikation:
Catarina Martins-Costa et al.
ARID1B controls transcriptional programs of axon projection in an organoid model of the human corpus callosum
Cell Stem Cell (2024)
DOI: 10.1016/j.stem.2024.04.014
Dem Forschungsteam rund um Jürgen Knoblich am Institut für Molekulare Biotechnologie (IMBA) der Österreichischen Akademie der Wissenschaften gelang es nun in einer Zusammenarbeit mit Gregor Kasprian und Kolleginnen und Kollegen der Medizinischen Universität Wien, ein Organoidmodell dieser Nervenbündel zu entwickeln.
Um die weitreichenden, stark genutzten Nervenbündel zu modellieren, griff das ForscherInnenteam auf Wissen über eine seltene Neuroentwicklungsstörung zurück, bei der sich die Verbindung zwischen linker und rechter Gehirnhälfte nicht ausbildet. Der Corpus callosum, die Brücke zwischen links und rechts in unserem Gehirn, ist eine besonders stark genutzte Informations-Autobahn. Allerdings bildet sich in sehr seltenen Fällen diese Verbindung während der Entwicklung im Mutterleib nicht aus. Dies kann im Rahmen der Ultraschallscreening Untersuchung um die 18. Schwangerschaftswoche bereits vor der Geburt festgestellt werden. „Mittels fetaler Magnetresonanztomographie (MRT) kann in solchen Fällen eine genaue bildgebende Darstellung des fetalen Gehirns sowie des fehlenden Corpus callosum und damit verbundener struktureller Auffälligkeiten erfolgen“, so der Neuroradiologe und Koautor Gregor Kasprian.
In rund 10 Prozent der Fälle ist der Auslöser eine Mutation im Gen ARID1B. „Klinisch ist bereits ausführlich beschrieben, dass Mutationen im Gen ARID1B mit einem Fehlen des Corpus callosum zusammenhängen. Bisher war aber nichts über die molekularen Mechanismen bekannt, die bei diesem Defekt eine Rolle spielen“, erklärt Catarina Martins-Costa, Erstautorin der Studie.
Aus Blutzellen zweier Patienten mit ARID1B-Mutation konnten die Forscherinnen und Forscher Stammzellen erzeugen, mit denen sie wiederum dreidimensionale Gehirnorganoide herstellten. Das Besondere an diesen Gehirnorganoiden: auch sie tragen die Mutation im ARID1B-Gen. Damit konnten die Forscherinnen und Forscher nun untersuchen, wie sich diese Mutation auf die Entwicklung weitreichender Nervenprojektionen auswirkt – ein Modell also für die Autobahnen im Gehirn.
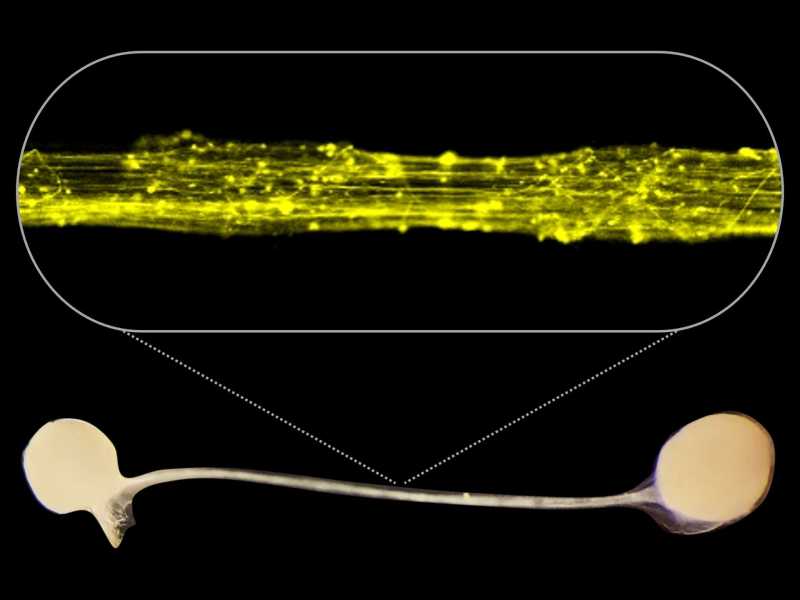
„Organoide ermöglichen es uns, alle Schritte der neuronalen Entwicklung zu verfolgen und direkt an menschlichem Gewebe zu untersuchen“, erklärt Jürgen Knoblich. Um die Verbindung zwischen zwei Gehirnhälften zu modellieren, arbeiteten die Forscherinnen und Forscher mit Yoshiho Ikeuchi von der Universität Tokio zusammen. Sie platzierten je zwei Gehirnorganoide in eine 3D-gedruckte Form, in der die Organoide durch einen Mikrokanal verbunden waren. Das ForscherInnenteam beobachtete, wie sich die beiden Organoide durch Nervenfortsätze, auch Axone genannt, miteinander verbanden. Tatsächlich hatte die ARID1B-Mutation große Auswirkungen auf die Konnektivität. „Gesunde Organoide bilden ein organisiertes Axonbündel mit vielen Axonen, die sich mit dem anderen Organoid verbinden. Mutierte ARID1B-Organoide bilden dieses Bündel ebenfalls, aber die Anzahl der verbindenden Axone ist stark reduziert“, berichtet Nina Corsini, ko-korrespondierende Autorin.
Weitere Untersuchungen ergaben, dass sich die Genexpression in ARID1B-mutierten Nervenzellen verändert, berichtet Martins-Costa. „Wir stellten fest, dass Gruppen von Genen, die für die neuronale Reifung und die Bildung von Axonen verantwortlich sind, weniger stark exprimiert waren. Das erklärt, warum mutierte Neuronen nicht in der Lage sind, weitreichende Axone, etwa für das Corpus callosum, zu bilden.“
Gehirnorganoide mit ARID1B-Mutation sind somit das erste Modell, an dem diese wichtige Nervenbahn des menschlichen Gehirns genau untersucht werden kann. Das hat hohe Relevanz auch für die klinische Forschung, betont Knoblich. „Unser System bietet eine innovative Technologie, mit der nun Gentherapien für Patienten mit ARID1B-Mutation getestet werden können. So arbeiten wir bereits mit der Patientenorganisation ‚The Foundation for ARID1B Research‘ zusammen, um eine Gentherapie zu testen, bevor sie in die Klinik kommt.“
Diese Newsmeldung wurde mit Material des IMBA - Instituts für Molekulare Biotechnologie der Österreichischenn Akademie der Wissenschaften GmbH via Informationsdienst Wissenschaft erstellt.