Neues von den bakteriellen Photorezeptoren
Bio-News vom 19.08.2021
Das Sonnenlicht beeinflusst viele biochemische Abläufe in Pflanzen, Tieren, Pilzen und Bakterien. In zahlreichen Organismen nehmen die Phytochrome, eine spezielle Klasse von Photorezeptoren, rotes oder fernrotes Licht auf und verwandeln es in Signale, die entsprechende physiologische Reaktionen auslösen. Ein internationales Team berichtet über eine überraschende Entdeckung: Zwei bakterielle Phytochrome funktionieren trotz ähnlichen Aufbaus auf entgegengesetzte Weise. Für die Erforschung lichtgesteuerter Prozesse in der Natur und biotechnologischer Anwendungen bieten diese Erkenntnisse neue Anknüpfungspunkte.
In Bakterien wird der Einfluss des Sonnenlichts auf den Organismus vielfach durch Signalsysteme gesteuert, an denen zwei Komponenten beteiligt sind. Die erste Komponente sind Photorezeptoren, häufig handelt es sich dabei um Phytochrome. Wie molekulare Schalter wechseln sie zwischen zwei Zuständen hin und her, in denen sie jeweils rotes oder fernrotes Licht aufnehmen. Dadurch lösen sie biochemische Signale aus, die an die zweite Komponente des Systems – den Antwortregulator – weitergeleitet werden. Der Antwortregulator wiederum setzt, abhängig von der Art und Intensität der Signale, bestimmte biochemische Prozesse – unter anderem die Expression von Genen – in den Bakterien in Gang.
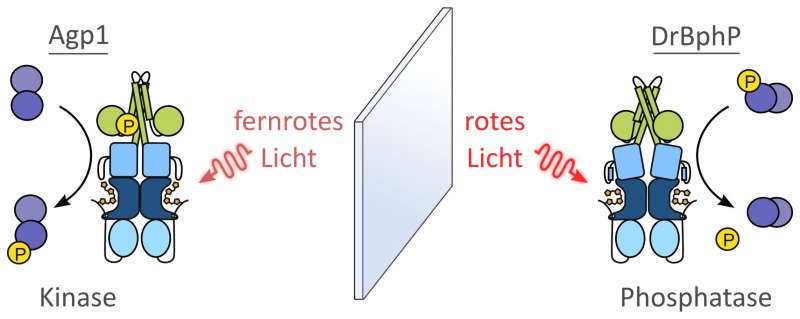
Normalerweise arbeiten bakterielle Phytochrome als Enzyme, die Phosphatgruppen auf Eiweißmoleküle übertragen. Diese Enzyme werden auch als Kinasen bezeichnet. Aber ausgerechnet im Phytochrom des Bakteriums Deinococcus radiodurans (DrBphP), das in der Forschung als wichtiges Modellsystem gilt, hat man seit gut 20 Jahren vergeblich nach einer solchen oder anders gearteten enzymatischen Aktivität gesucht. Trotz enormer Relevanz als Modellsystem blieb die genaue biologische Funktion des DrBphP somit unklar. Die biochemische Arbeitsgruppe von Prof. Dr. Andreas Möglich an der Universität Bayreuth hat, in Kooperation mit Forschungspartnern in Finnland, dieses seit langem bestehende Rätsel jetzt aufgeklärt. Das Phytochrom des Modellbakteriums D. radiodurans tanzt tatsächlich aus der Reihe: Es verhält sich ähnlich wie eine andere Klasse von Enzymen, die Phosphatgruppen von benachbarten Molekülen abspalten und deshalb Phosphatasen heißen.
Publikation:
Elina Multamäki et al.
Comparative analysis of two paradigm bacteriophytochromes reveals opposite functionalities in two-component signaling
Nature Communications (2021), 12, 4394
Die Forscherinnen und Forscher haben dieses Ergebnis durch einen Vergleich mit dem Phytochrom des Bakteriums Agrobacterium fabrum (Agp1) erzielt. Dieses Phytochrom fördert – wie es für Kinasen charakteristisch ist – nicht die Abspaltung, sondern die Übertragung von Phosphatgruppen. „Der Vergleich der aus zwei verschiedenen Bakterienarten stammenden Phytochrome ist deshalb so spannend, weil sie einander spiegelbildlich entgegengesetzte Funktionen haben, obwohl sie sich hinsichtlich ihres molekularen Bauplans sehr ähneln. Und noch eine weitere Auffälligkeit haben wir festgestellt: Die beiden Funktionen verteilen sich, wiederum gegenläufig, auf zwei entgegengesetzte Zustände. Das Phytochrom Agp1 entfaltet seine Kinase-Aktivität, wenn es fernrotes Licht aufnimmt. Umgekehrt startet die Phosphatase-Aktivität des Phytochroms DrBphP, wenn es rotes Licht aufnimmt. Durch diese vergleichende Analyse konnten wir gut 20 Jahre nach seiner Entdeckung erstmalig eine enzymatische Aktivität für DrBphP nachweisen. Aus diesen Erkenntnissen könnten sich interessante Ansatzpunkte für die Optogenetik ergeben, insbesondere für den Bau künstlicher Lichtrezeptoren, mit denen sich zelluläre Prozesse steuern lassen“, sagt Prof. Möglich.
Letztautor der in „Nature Communications“ veröffentlichten Studie ist Dr. Heikki Takala, Academy Research Fellow an der Universität Jyväskylä in Finnland und zuvor Leiter einer Nachwuchsforschergruppe an der Universität Helsinki. Im Jahr 2020 wurde er vom University of Bayreuth Centre of International Excellence “Alexander von Humboldt" als Senior Fellow ausgewählt. Während seines Forschungsaufenthalts in Bayreuth kooperierte er mit der Bayreuther Arbeitsgruppe von Prof. Möglich. „Die Zusammenarbeit in unserem Bayreuther Team hat sich wissenschaftlich als sehr erfolgreich erwiesen und hat auch mein Netzwerk persönlicher Kontakte sehr erweitert. Unseren Austausch über aktuelle Fragen in der Photobiochemie intensivieren wir deshalb auch nach der jetzt veröffentlichten Studie weiter. Die Ergebnisse zeigen, dass wir bei der Erforschung der Lichtsteuerung biochemischer Prozesse in vieler Hinsicht noch am Anfang stehen. Im Rahmen eines Forschungsaufenthalts meiner Mitarbeiterin Elina Multamäki in Bayreuth werden wir just ab September 2021 unsere neuen Erkenntnisse in eine biotechnologische Anwendung des DrBphP umsetzen“, sagt Dr. Takala.
Diese Newsmeldung wurde mit Material der Universität Bayreuth via Informationsdienst Wissenschaft erstellt.