Vom Schalten und Walten in Bakterien
Bio-News vom 06.08.2021
Wie halten sich Krankheiten auslösende Bakterien am Leben? Biochemisch gesprochen: Wie funktioniert ihre Genregulation und Gensynthese, also die gengesteuerte Produktion von Proteinen? Forscherinnen und Forscher des Instituts für Organische Chemie und Chemische Biologie der Goethe-Universität haben nun herausgefunden, wie sich ein bakterieller Genschalter am Ort der bakteriellen Gensynthese, dem Ribosom, strukturell verhält. Nur seine Wechselwirkung mit einem ribosomalen Protein macht den Fortbestand des Bakteriums möglich, wie die Forscherinnen und Forscher in der Fachzeitschrift Nature Communications demonstrieren.
Antibiotika setzen bakterielle Keime außer Kraft: Sie hemmen deren Wachstum oder lassen sie gar absterben, indem sie deren biologische Funktionen stören. Wenn die gleichen Antibiotika jedoch häufig eingesetzt werden, entwickeln Bakterien Resistenz, und das Antibiotikum verliert seine Wirkung. Je genauer Forscher nun die biologischen Prozesse in Bakterien kennen und wissen, wie Bakterien sich reproduzieren, desto gezielter können sie in diese Prozesse eingreifen – etwa durch neue Antibiotika.
Publikation:
Vanessa de Jesus, Nusrat S. Qureshi, Sven Warhaut, Jasleen K. Bains, Marina S. Dietz, Mike Heilemann, Harald Schwalbe, Boris Fürtig
Switching at the ribosome: riboswitches need rProteins as modulators to regulate translation
Nature Communications
DOI: 10.1038/s41467-021-25024-5
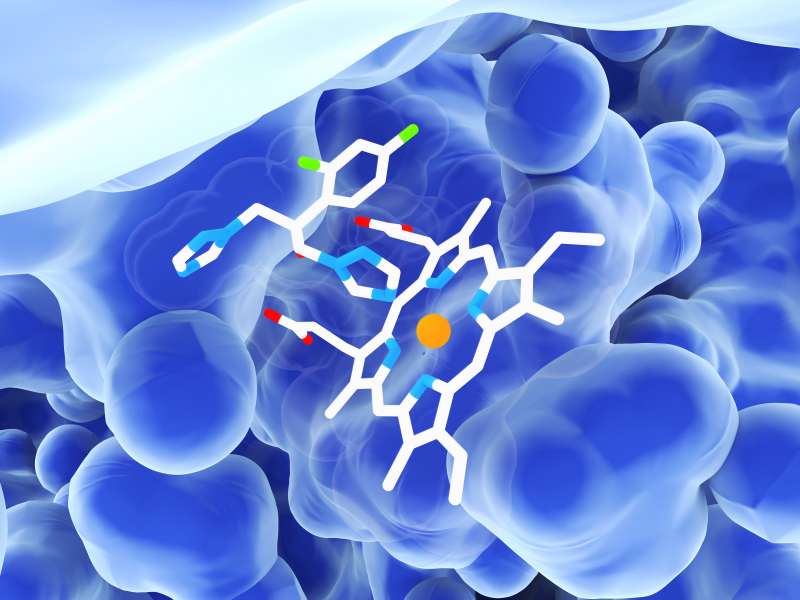
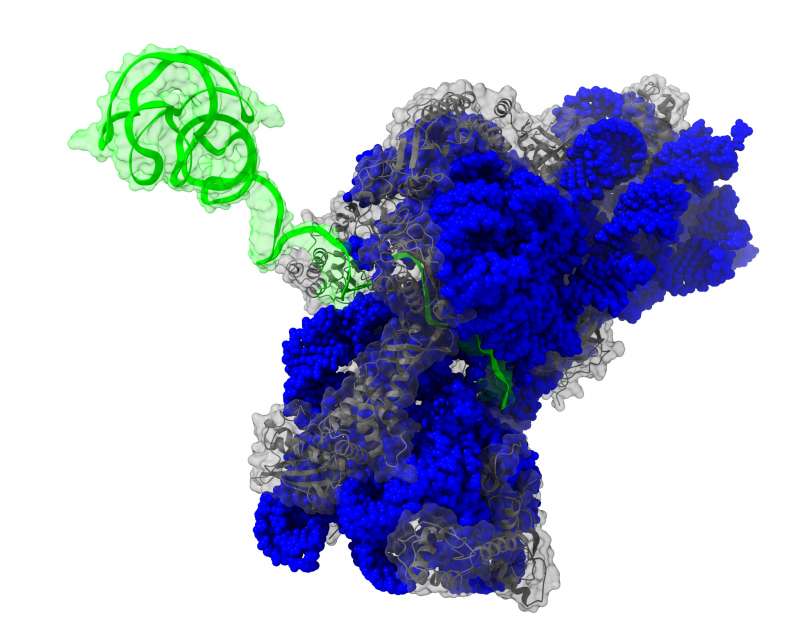
Neue Erkenntnisse über einen Mechanismus zur Regulation der bakteriellen Gensynthese haben jetzt Forschende des Instituts für Organische Chemie und Chemischen Biologie der Goethe-Universität gewonnen. Sie untersuchten dabei einen sogenannten Riboschalter aus dem krankheitsauslösenden Bakterium Vibrio vulnificus. Riboschalter (Riboswitches) sind strukturierte Elemente auf der Boten-Ribonukleinsäure (mRNA), die genetische Information zum Ort der Gensynthese, dem Ribosom, transportiert. Die Schalter können dabei zwei Strukturen einnehmen, die das Ribosom als AN- oder AUS-Signal erkennt. Abhängig davon, ob diese genetische Ampel rot oder grün zeigt, findet dann Gensynthese statt oder eben nicht. Ob der Schalter grün oder rot anzeigt, hängt wiederum von kleinen Molekülen ab, die als Induktoren funktionieren. Sind diese häufig in der Zelle anzutreffen, schaltet die Ampel auf Grün. Bislang ging man davon aus, dass allein die Anwesenheit der Induktoren den Schalter in Gang setzt.
Als Teil ihrer Doktorarbeit konnte Vanessa de Jesus in der Arbeitsgruppe von Dr. Boris Fürtig nun zeigen, dass dazu jedoch eine Wechselwirkung vonnöten ist: zwischen dem Riboschalter, der durch den Induktor aktiviert wird, und dem Ribosom selbst, das seinerseits auf den Schalter einwirkt. „Nur die Synergie der Bindung des Induktors Adenin und des Ribosoms, insbesondere des Proteins rS1, ermöglicht eine vollständige Umschaltung“, erklärt Vanessa de Jesus.
Prof. Dr. Harald Schwalbe, aus dessen Sonderforschungsbereich zu molekularen Mechanismen der RNA-basierten Regulation die Arbeitsgruppe erwachsen ist, untersucht seit langem diese Art von Genregulation: „Bislang stand die Wechselwirkung zwischen Induktormolekül und Riboschalter im Fokus unseres wissenschaftlichen Interesses. Die Interaktion der Riboswitche mit dem Ribosom konnte jetzt von der Gruppe Fürtig federführend erforscht werden. Somit verstehen wir auch zunehmend besser das komplizierte dynamische Netzwerk von RNA-Schalter, Induktor und Ribosomen-Protein-Modulator.“
„Wir sind sehr glücklich, dass wir nach sechs Jahren sehr intensiver Arbeit gemeinsam mit den Kollegen aus dem Institut für Physikalische Chemie zeigen können, dass Riboschalter mitnichten ein rein RNA-basiertes Regulationssystem sind. Sie brauchen die Wechselwirkung mit Proteinen der Gensynthese-Maschine, um korrekt zu funktionieren. Damit haben wir völlig neue Angriffspunkte für Antibiotika“, erläutert Dr. Boris Fürtig die Forschungserkenntnisse seiner Gruppe. Ziel ist es, Moleküle herzustellen, die in die Regulation der Gensynthese von Bakterien punktgenau eingreifen und das Wachstum der Keime hemmen können.
Diese Newsmeldung wurde mit Material der Goethe-Universität Frankfurt am Main via Informationsdienst Wissenschaft erstellt.