Zusatzantrieb für die Photosynthese
Bio-News vom 23.01.2019
Die Photosynthese ist ein grundlegender biologischer Prozess, der es Pflanzen ermöglicht, Lichtenergie für ihr Wachstum zu nutzen. Die meisten Lebensformen auf der Erde hängen direkt oder indirekt von der Photosynthese ab. Forscher des Max-Planck-Instituts für Biochemie in Martinsried bei München haben gemeinsam mit Kollegen von der Australian National University die Bildung von Carboxysomen untersucht – einer Struktur, die die Effizienz der Photosynthese in wasserlebenden Bakterien steigert. Ihre Ergebnisse, die jetzt in Nature veröffentlicht wurden, könnten zur Entwicklung von Pflanzen mit einer effizienteren Photosynthese und somit höheren Ernteerträgen führen.
Mit einem weltweiten Bevölkerungswachstum von schätzungsweise 80 Millionen Menschen jährlich nimmt auch die Nahrungsmittelnachfrage stetig zu. Um diesem Bedarf gerecht zu werden, arbeiten Wissenschaftler an Strategien mit denen sich die Produktivität von Nutzpflanzen steigern lässt.
Photosynthese – entscheidend, aber ineffizient
Während die meisten Organismen auf die Aufnahme von Nährstoffen angewiesen sind, um Energie für ihre Zellen zu erzeugen, können Pflanzen sowie einige Mikrobenarten ihre Zellen mit Lichtenergie versorgen. In einem Prozess der als Photosynthese bezeichnet wird, wandeln sie dabei Wasser und Kohlenstoffdioxid (CO2) mit Hilfe von Sonnenlicht in Zucker und Sauerstoff um. Entscheidend für diese Reaktion ist das Enzym Rubisco, das für die Fixierung von CO2 aus der Atmosphäre verantwortlich ist.
Publikation:
Wang H*, Yan X*, Aigner H, Bracher A, Nguyen ND, Hee WY, Long BM, Price GD, Hartl FU, Hayer-Hartl M. (* trugen zu gleichen Teilen bei)
Rubisco condensate formation by CcmM in β-carboxysome biogenesis
Nature, Januar 2019
DOI: 10.1038/s41586-019-0880-5
Rubisco, das als das am häufigsten auf der Erde vorkommende Enzym gilt, arbeitet allerdings langsam und ineffektiv. Statt CO2 zu fixieren, kann Rubisco auch mit Sauerstoff reagieren. Bei dieser Nebenreaktion geht viel Energie verloren. Deshalb versuchen Wissenschaftler, eine effizientere Version von Rubisco zu entwickeln, um das Pflanzenwachstum zu fördern. Ein Team unter der Leitung von Manajit Hayer-Hartl, Leiterin der Forschungsgruppe „Chaperonin-vermittelte Proteinfaltung” am Max-Planck-Institut für Biochemie in Martinsried, hat jetzt einen wichtigen Beitrag zu diesen Bemühungen beigesteuert.
Cyanobakterien sind wasserlebende Mikroben, die Photosynthese betreiben. Sie haben dazu eine Strategie entwickelt, die die Effizienz ihres Rubisco-Enzyms steigert. Dazu erhöhen die Cyanobakterien die CO2-Konzentration in speziellen Strukturen, den sogenannten Carboxysomen, und beschränken ihr Rubisco auf diese Strukturen. So reduzieren sie den Energieverlust, der durch die Nebenreaktion mit Sauerstoff entsteht. In der neuen Studie konnte jetzt gezeigt werden, wie die Bildung von Carboxysomen eingeleitet wird.
Rubisco einfangen für zusätzliche Energie
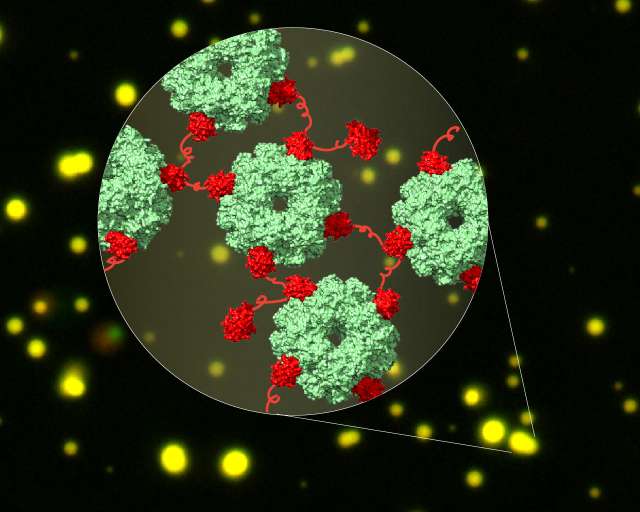
Cyanobakterien nutzen das Helferprotein CcmM, um Rubisco einzufangen. CcmM besteht aus mehreren sich wiederholenden Modulen, die der kleinen Untereinheit des Rubisco gleichen. Deshalb vermutete man lange, dass diese Module bei einer Interaktion der Proteine die kleinen Rubisco-Untereinheiten ersetzen und dadurch Rubisco-Proteine miteinander verbinden. Der Komplex zwischen CcmM und Rubisco ist jedoch von einer hohen Dynamik geprägt und konnte deshalb nicht durch traditionelle Methoden der Strukturbiologie aufgeklärt werden. „Wir haben in dieser Studie die Vorteile der sich rasant entwickelnden Kryo-Elektronenmikroskopie genutzt, um diese dynamischen Interaktionen zu erfassen”, erläutert Huping Wang, eine der Erstautoren der Studie. Mit Hilfe der Kryo-EM gelang den Forschern der Nachweis, dass CcmM nicht die kleine Untereinheit des Rubisco ersetzt, sondern Rubisco-Proteine über einen unerwarteten Mechanismus miteinander verknüpft.
Die Interaktion zwischen CcmM und Rubisco verursacht die Entmischung des Proteinkomplexes von anderen Proteinen in der Zelle. „Diese Entmischung von Proteinen wird als Phasentrennung bezeichnet und ist ein Prozess, bei dem Proteine lokal konzentriert werden. In Cyanobakterien bildet sich dann die Proteinhülle des Carboxysoms rund um das phasengetrennte CcmM und Rubisco, um diese einzufangen“, beschreibt Xiao Yan, ebenfalls Erstautor der Studie. Ein ähnlicher Prozess der Phasentrennung von Proteinen ist auch an der Entstehung von neurodegenerativen Erkrankungen wie der amyotrophen Lateralsklerose beteiligt.
Die Carboxysom-Bildung fördert die Photosynthese, weil diese Mikrokompartimente den CO2-Gehalt im Umkreis von Rubisco erhöhen und das Enzym so effizienter arbeiten lassen. Die aktuellen Ergebnisse der Studie tragen enorm zur Verbesserung des Verständnisses bei, wie diese CO2-konzentrierenden Strukturen gebildet werden.
Manajit Hayer-Hartl beschreibt eine mögliche Anwendung der Studienergebnisse: „Wenn wir funktionierende Carboxysome auf höhere Pflanzen übertragen könnten, würde das die Nutzpflanzen zusätzlich anregen, CO2 noch effizienter zu fixieren. Dann würde die Energie, die normalerweise in der Reaktion von Rubisco mit Sauerstoff verloren geht, für die Erzeugung von Biomasse zur Verfügung stehen.“ Langfristig könnten die Forschungserkenntnisse von Hayer-Hartl dazu beitragen, effizientere Nutzpflanzen zu züchten, den Einsatz von Kunstdüngern zu reduzieren und die weltweite Nahrungsversorgung zu verbessern. [CW]
Rubisco einfangen für zusätzliche Energie
Cyanobakterien nutzen das Helferprotein CcmM, um Rubisco einzufangen. CcmM besteht aus mehreren sich wiederholenden Modulen, die der kleinen Untereinheit des Rubisco gleichen. Deshalb vermutete man lange, dass diese Module bei einer Interaktion der Proteine die kleinen Rubisco-Untereinheiten ersetzen und dadurch Rubisco-Proteine miteinander verbinden. Der Komplex zwischen CcmM und Rubisco ist jedoch von einer hohen Dynamik geprägt und konnte deshalb nicht durch traditionelle Methoden der Strukturbiologie aufgeklärt werden. „Wir haben in dieser Studie die Vorteile der sich rasant entwickelnden Kryo-Elektronenmikroskopie genutzt, um diese dynamischen Interaktionen zu erfassen”, erläutert Huping Wang, eine der Erstautoren der Studie. Mit Hilfe der Kryo-EM gelang den Forschern der Nachweis, dass CcmM nicht die kleine Untereinheit des Rubisco ersetzt, sondern Rubisco-Proteine über einen unerwarteten Mechanismus miteinander verknüpft.
Die Interaktion zwischen CcmM und Rubisco verursacht die Entmischung des Proteinkomplexes von anderen Proteinen in der Zelle. „Diese Entmischung von Proteinen wird als Phasentrennung bezeichnet und ist ein Prozess, bei dem Proteine lokal konzentriert werden. In Cyanobakterien bildet sich dann die Proteinhülle des Carboxysoms rund um das phasengetrennte CcmM und Rubisco, um diese einzufangen“, beschreibt Xiao Yan, ebenfalls Erstautor der Studie. Ein ähnlicher Prozess der Phasentrennung von Proteinen ist auch an der Entstehung von neurodegenerativen Erkrankungen wie der amyotrophen Lateralsklerose beteiligt.
Die Carboxysom-Bildung fördert die Photosynthese, weil diese Mikrokompartimente den CO2-Gehalt im Umkreis von Rubisco erhöhen und das Enzym so effizienter arbeiten lassen. Die aktuellen Ergebnisse der Studie tragen enorm zur Verbesserung des Verständnisses bei, wie diese CO2-konzentrierenden Strukturen gebildet werden.
Manajit Hayer-Hartl beschreibt eine mögliche Anwendung der Studienergebnisse: „Wenn wir funktionierende Carboxysome auf höhere Pflanzen übertragen könnten, würde das die Nutzpflanzen zusätzlich anregen, CO2 noch effizienter zu fixieren. Dann würde die Energie, die normalerweise in der Reaktion von Rubisco mit Sauerstoff verloren geht, für die Erzeugung von Biomasse zur Verfügung stehen.“ Langfristig könnten die Forschungserkenntnisse von Hayer-Hartl dazu beitragen, effizientere Nutzpflanzen zu züchten, den Einsatz von Kunstdüngern zu reduzieren und die weltweite Nahrungsversorgung zu verbessern. [CW]
Diese Newsmeldung wurde via Informationsdienst Wissenschaft erstellt.