Nickel(II)-carbonat
- Seiten mit Skriptfehlern
- Seiten, die Referenzierungsfehler enthalten
- Wikipedia:Vorlagenfehler/Vorlage:GESTIS
- Wikipedia:Vorlagenfehler/Vorlage:Infobox Chemikalie
- Wikipedia:Wikidata-Wartung:PubChem abweichend
- Wikipedia:Wikidata-Wartung:DrugBank fehlt lokal
- Wikipedia:Vom Gesetzgeber eingestufter Gefahrstoff
- Krebserzeugender Stoff
- Erbgutverändernder Stoff
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- Gesundheitsschädlicher Stoff bei Einatmen
- Gesundheitsschädlicher Stoff bei Verschlucken
- Hautreizender Stoff
- Sensibilisierender Stoff
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Wikipedia:Verwendet aufgehobene P-Sätze
- Wikipedia:Wikidata-Wartung:CAS-Nummer fehlt lokal
- Wikipedia:Beobachtung/Vorlage:Infobox Chemikalie/Summenformelsuche nicht möglich
- Nickelverbindung
- Carbonat
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
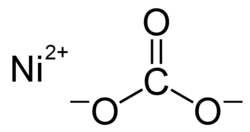
| ||||||||||
| Allgemeines | ||||||||||
| Name | Nickel(II)-carbonat | |||||||||
| Andere Namen |
Nickelcarbonat | |||||||||
| Summenformel | NiCO3 | |||||||||
| Kurzbeschreibung |
hellgrüner geruchloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 118,70 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Dichte |
2,6 g·cm−3[1] | |||||||||
| Schmelzpunkt |
120–350 °C (Zersetzung)[1] | |||||||||
| Löslichkeit |
Praktisch unlöslich in Wasser (93 mg·l−1 bei 25 °C)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Nickel(II)-carbonat ist eine chemische Verbindung aus der Gruppe der Nickelverbindungen und Carbonate welche in mehreren Hydratformen vorkommt.
Vorkommen
Nickel(II)-carbonat kommt natürlich in als Mineral Hellyerit (Hexahydrat) sowie Zaratit, Nullaginit und Otwayit (Hydroxycarbonate) vor.
Gewinnung und Darstellung
Nickel(II)-carbonat-Hydrate können durch Elektrolyse von mit Kohlendioxid gesättigtem Wasser an Nickelelektroden gewonnen werden. Wasserfreies Nickel(II)-carbonat kann durch Reaktion einer Natriumhydrogencarbonat-Lösung mit einer mit Salzsäure angesäuerten Nickel(II)-chlorid-Lösung bei hohen Temperaturen und hohem Druck gewonnen werden. Es existiert auch eine gelbe Modifikation die bei anderen Druck-, Temperatur und Konzentrationsverhältnissen entsteht.[3] Nickel(II)-carbonat entsteht auch bei der Zersetzung von Nickelcarbonyl.[4]
Eigenschaften
Nickel(II)-carbonat und seine Hydrate sind hellgrüne geruchlose Feststoffe die sich bei Temperaturen größer als 120 °C in Kohlendioxid und Nickel(II)-oxid zersetzen. Wasserfreies Nickel(II)-carbonat ist unlöslich in Wasser und Säuren, dessen Hydrate sind jedoch leicht löslich in Säuren. Es kristallisiert rhomboedrisch mit der Raumgruppe R3c (a = 780,7 pm, a = 48°40').[3][4] Wasserfreies Nickelcarbonat ist nur schwer darstellbar. Die im Handel befindlichen Nickelcarbonate, sind basisch (Nickelhydroxycarbonat, NiCO3 · x Ni(OH)2 · x H2O, CAS: 12607-70-4, 12122-15-5 oder 12244-51-8) und schwer wasserlöslich.[1] Sie entstehen durch Fällung von Nickelsalzlösungen mit Natriumcarbonat.
Verwendung
Nickel(II)-carbonat wird als Katalysator bei der Fetthärtung und zur Herstellung von Nickel(II)-oxid, keramischen Farben (Pigment) und Glasuren sowie beim Galvanisieren verwendet.[1]
Sicherheitshinweise
Nickel(II)-carbonat ist wie viele Nickelverbindungen als krebserzeugend und reproduktionstoxisch eingestuft.[1]
Weblinks
Einzelnachweise
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Eintrag zu CAS-Nr. 3333-67-3 in der GESTIS-Stoffdatenbank des IFA (JavaScript erforderlich)
- ↑ 2,0 2,1 Referenzfehler: Es ist ein ungültiger
<ref>-Tag vorhanden: Für die Referenz namensESISwurde kein Text angegeben. - ↑ 3,0 3,1 Georg Brauer; Handbuch der präparativen anorganischen Chemie
- ↑ 4,0 4,1 Nickel and its compounds (Inchem)