Evolution formt Struktur und Funktion eines Proteins in Fliegen
Bio-News vom 12.03.2021
Gemeinsam mit Kollegen aus den USA und Australien haben Bioinformatiker der Westfälischen Wilhelms-Universität (WWU) Münster wichtige Aspekte der Evolutionsgeschichte analysiert. Sie untersuchten, wie ein Protein, welches essenziell für die Fruchtbarkeit von männlichen Taufliegen ist und das quasi „aus dem Nichts“ entstand, funktional wurde und eine relativ stabile Struktur angenommen hat.
Proteine bilden den Hauptbestandteil aller modernen Lebensformen: Beispielsweise transportiert der eisenhaltige Proteinkomplex Hämoglobin den Sauerstoff in unserem Blut, Photosynthese-Proteine in den Pflanzenblättern wandeln Sonnenlicht in Energie um und Pilzenzyme helfen uns, Bier zu brauen und Brot zu backen. Wissenschaftlerinnen und Wissenschaftler beschäftigen sich bereits lange mit der Frage, wie sich Proteine im Laufe der Jahrtausende verändern oder neu entstehen. Dass vollständige neue Proteine und somit neue Eigenschaften quasi aus dem Nichts entstehen, galt jahrzehntelang als undenkbar – frei nach dem Motto des griechischen Philosophen Parmenides, dass „Nichts aus nichts entstehen kann“ (lateinisch: „ex nihilo nihil fit“).
Publikation:
Andreas Lange, Prajal H. Patel, Brennen Heames, Adam M. Damry, Thorsten Saenger, Colin J. Jackson, Geoffrey D. Findlay, Erich Bornberg-Bauer
Structural and functional characterization of a putative de novo gene in Drosophila
Nat Commun 12, 1667 (2021)
DOI: 10.1038/s41467-021-21667-6
Wissenschaftler der Westfälischen Wilhelms-Universität (WWU) Münster haben jetzt mit Kollegen aus den USA und Australien herausgefunden, wie die Evolution die Struktur und Funktion eines neu entstandenen Proteins „aus dem Nichts“ in Taufliegen formt. Dieses Protein ist für die männliche Fruchtbarkeit essenziell. Die Ergebnisse sind in der Zeitschrift „Nature Communications“ veröffentlicht.
Was bisher galt
Bislang wurde angenommen, dass neue Proteine aus bereits bestehenden Proteinen entstehen, und zwar durch Duplikation, also Verdoppelung der zugrundeliegenden Gene, und eine Reihe von kleinen Veränderungen („Mutationen“) in einer oder in beiden Gen-Kopien.
Das Neue
In den vergangenen zehn Jahren hat sich jedoch ein neues Verständnis der Proteinevolution entwickelt: Proteine können sich auch aus sogenannter nicht-codierender DNA (Desoxyribonukleinsäure) entwickeln, also aus dem Teil des Erbguts, der normalerweise keine Proteine erzeugt, und zu funktionstüchtigen Zellbestandteilen werden. Das ist aus mehreren Gründen überraschend: Man hatte viele Jahre angenommen, dass Proteine eine hochentwickelte geometrische Form (eine „3D-Struktur“) annehmen müssen, um zu funktionieren. Weiter wurde angenommen, dass sich eine solche Form nicht aus einem zufällig entstandenen Gen bildet, sondern eine komplexe Kombination von Aminosäuren benötigt, die die Struktur dieser Proteine in ihrer funktionellen Form ermöglicht.
Trotz jahrzehntelanger Bemühungen ist es Forschern weltweit bisher nicht gelungen, Proteine mit den gewünschten 3D-Strukturen und Funktionen zu konstruieren, sodass der „Code“ für die Bildung eines funktionellen Proteins im Wesentlichen unbekannt ist. Während diese Aufgabe für die Wissenschaft ein Rätsel ist, hat sich die Natur als geschickter erwiesen, neue Proteine zu bilden. Durch den Vergleich der neu analysierten Genome vieler Organismen fanden Wissenschaftler unter der Leitung der Arbeitsgruppe von Prof. Dr. Erich Bornberg-Bauer (Institut für Evolution und Biodiversität der WWU) heraus, dass sich Arten nicht nur durch duplizierte und im Laufe der Evolution angepasste protein-kodierende Gene unterscheiden. Zusätzlich werden ständig Proteine „de novo“ (lateinisch für „von Neuem“) gebildet – das heißt, ohne dass ein verwandtes Vorläuferprotein einen Selektionsprozess durchlaufen hat.
Die meisten dieser neu gebildeten Proteine sind nutzlos oder schädlich, da sie sich negativ auf das Überleben oder den Fortpflanzungserfolg auswirken. Einige De-novo-Proteine haben jedoch vorteilhafte Funktionen. Diese Proteine integrieren sich in die molekularen Bestandteile der Zellen und werden schließlich, nach Millionen von Jahren kleiner Anpassungen, unverzichtbar. Wichtige Fragen, die sich viele Wissenschaftler in diesem Zusammenhang stellen: Wie sehen solche neuartigen Proteine bei ihrem Entstehen aus? Wie verändern sie sich im Laufe der Zeit? Welche Funktionen übernehmen sie zukünftig? Das Team um Erich Bornberg-Bauer in Münster ist mit internationalen Kollegen diesen Fragen nachgegangen – am Beispiel von „Goddard“. Dieses Protein kommt bei Taufliegen (Drosophila) vor und ist für die männliche Fruchtbarkeit essenziell.
Methodisches Vorgehen

© Mareike Kopping
Dr. Prajal Patel und Prof. Dr. Geoff Findlay vom College of the Holy Cross in Massachusetts (USA) zeigten mit Hilfe von CRISPR/Cas9 Genome Editing – einer molekularbiologischen Methode, um DNA gezielt zu schneiden und zu verändern –, dass männliche Fliegen, die Goddard nicht produzieren, mangels funktionierender Spermien steril sind, aber ansonsten gesund.
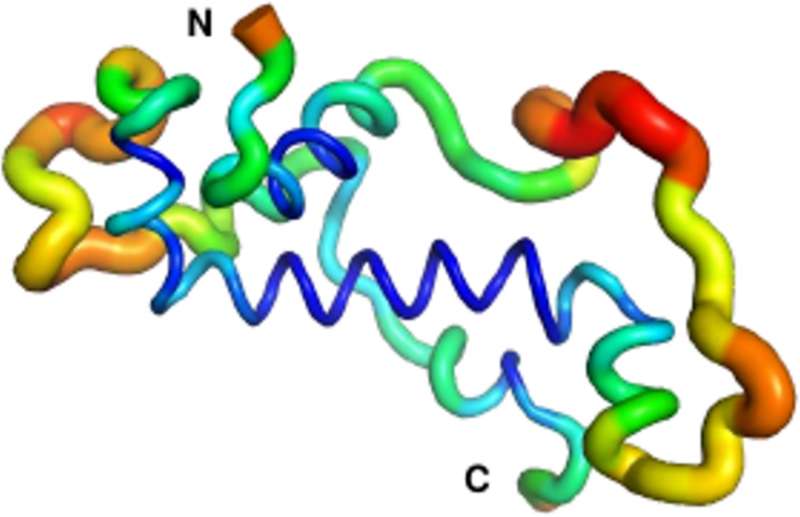
Die münsterschen Bioinformatiker Dr. Andreas Lange und der Doktorand Brennen Heames sagten die Struktur des neuen Proteins in heutigen Fliegen mit Hilfe von Computersimulationen und spektroskopischen Methoden vorher.
Anschließend benutzten sie evolutionäre Methoden, um die wahrscheinliche Struktur von Goddard vor etwa 50 Millionen Jahren zu rekonstruieren, als das Protein erstmals auftrat. Was sie dabei herausfanden, war eine Überraschung:
„Das uralte Goddard-Protein sah schon sehr ähnlich aus wie das, das heute in Fliegenarten existiert. Goddard enthielt von Anfang an einige Strukturelemente, so genannte Alpha-Helices, von denen man annimmt, dass sie für die meisten Proteine essenziell sind“, erklärt Erich Bornberg-Bauer.
Um diese Erkenntnisse zu bestätigen, verifizierten Dr. Adam Damry und Prof. Dr. Colin Jackson von der Australian National University in Canberra die vorhergesagte Form des Goddard-Proteins durch rechnerische Simulationen.
Sie bestätigten die Strukturanalyse der münsterschen Wissenschaftler und zeigten, dass Goddard trotz seines jungen Alters bereits recht stabil ist – wenn auch nicht ganz so stabil wie die meisten Fliegenproteine, von denen man annimmt, dass sie schon mehrere hundert Millionen Jahre existieren.
Die Ergebnisse stehen im Einklang mit mehreren anderen aktuellen Studien, die gezeigt haben, dass die genomischen Elemente, aus denen protein-kodierende Gene entstehen, häufig aktiviert werden, zehntausende Male in jedem Individuum. Diese Fragmente werden dann durch den Prozess der evolutionären Selektion „sortiert“. Diejenigen, die nutzlos oder schädlich sind – die große Mehrheit – werden schnell verworfen. Aber diejenigen, die weder schaden noch nutzen oder leicht vorteilhaft sind, können über Jahrtausende optimiert und in etwas Nützliches verwandelt werden.
Diese Newsmeldung wurde mit Material der Westfälischen Wilhelms-Universität Münster via Informationsdienst Wissenschaft erstellt.