Neu entdeckte Ionenkanalfamilie gibt Fischspermien den Takt vor
Bio-News vom 03.06.2020
Fische leben sowohl in Salz- als auch Süßwasser. Wie aber passt sich ihre Fortpflanzung an die verschiedenen Lebensräume an? Eine neue Studie von caesar-Wissenschaftlern in den "Proceedings der National Academy of Sciences" zeigt, dass die Spermien des im Süßwasser lebenden Zebrafisches über spezielle Ionenkanäle verfügen.
Die Fortpflanzung ist für Wasserorganismen eine große Herausforderung. Spermien und Eier werden ins Wasser abgegeben, die Spermien begeben sich auf den Weg zum Ei, um damit zu verschmelzen. Die Befruchtung bei wirbellosen Meerestieren, insbesondere von Seeigeln, ist gut erforscht. Es wurden mehrere Schlüsselproteine identifiziert, insbesondere Ionenkanäle und Transporter, die das Schwimmverhalten der Spermien steuern. Ganz anders jedoch bei Fischen. Fischspermien sind – je nach Lebensraum – völlig unterschiedlichen Bedingungen ausgesetzt, denn es gibt sowohl Süß-, als auch Salzwasserfische. Ist es möglich, dass das Schwimmverhalten der Spermien in beiden Lebensräumen von denselben Mechanismen gesteuert werden?
Publikation:
Wobig et al.
A family of hyperpolarization-activated channels selective for protons
Prog. Natl. Acad. Sci U.S.A. 2020
Das Problem: Für den Flagellenschlag, mit dem sich Spermien fortbewegen, ist die Aktivität von Ionenkanälen zwingend erforderlich. In Süßwasser sind aber nur wenige Ionen enthalten. Das würde bei vielen Ionenkanälen die Funktion umkehren. Auch sind einige Ionengradienten in Süßwasser – im Vergleich zu Salzwasser - genau entgegengesetzt ausgerichtet. Die Mechanismen, mit denen sich die Spermien von Salzwasserlebewesen fortbewegen, würden im Süßwasser sehr wahrscheinlich nicht funktionieren.
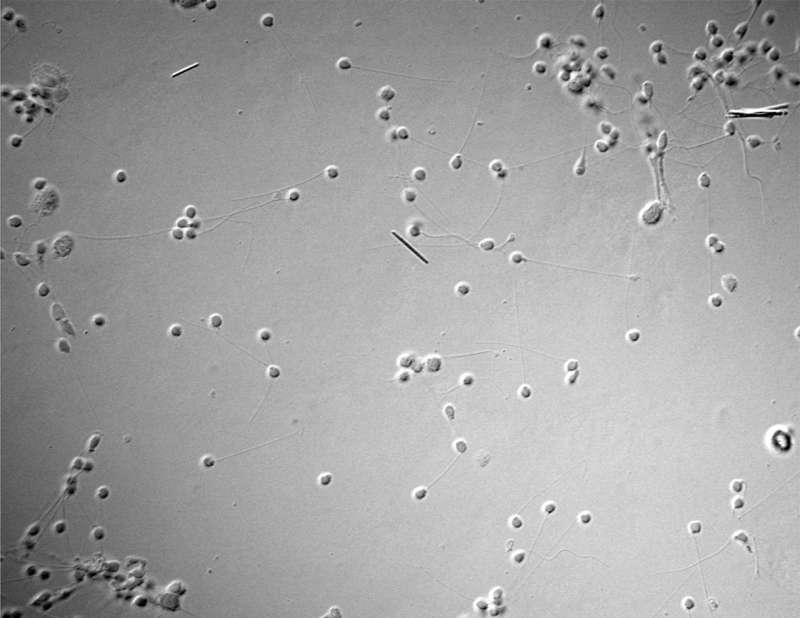
Wie können die Spermien in Süßwasser dennoch erfolgreich navigieren? Lea Wobig und Marie-Thérèse Wolfenstetter, Doktorandinnen in der Arbeitsgruppe von Prof. Kaupp, beantworten diese Frage in einer neuen Studie. Für ihre Arbeit untersuchten sie die Spermien des Zebrafisches (Abbildung 1). Ihre Vermutung: die Spermien von Süßwasserorganismen verfügen über spezielle Ionenkanäle.
HCN-like-Schrittmacherkanäle steuern die Fortbewegung der Spermien im Süßwasser
Spermien können, ähnlich wie Nervenzellen, elektrisch erregt werden. Spannungsgesteuerte Ionenkanäle sitzen in der Zellmembran und können Ionen in die Zelle ein- oder ausleiten. Sie öffnen oder schließen, wenn sich die Spannung über der äußeren Schicht der Zelle, der Membran, ändert. Abbildung 2 (links) zeigt die Grundarchitektur eines spannungsgesteuerten Ionenkanals. Vier Untereinheiten bilden zusammen eine zentrale Porendomäne (PD, magenta) aus, die den Durchgang von Ionen ermöglicht. Die seitlichen Domänen werden als "Spannungssensordomänen" oder VSDs (für Voltage-Sensing Domain, blau) bezeichnet. Geladene Aminosäuren in dieser Domäne „spüren“ die Membranspannung. Sie reagieren und öffnen oder schließen den Weg für die Ionen durch den Kanal.
Bei der Untersuchung von Zebrafischspermien entdeckten die Wissenschaftlerinnen eine neuartige Klasse spannungsgesteuerter Ionenkanäle, die sie als HCN-like-Kanäle bezeichnen. Diese Kanäle werden aktiviert, wenn die Membranspannung negativer wird. Das ermöglicht den Zellen, normalerweise in Verbindung mit anderen Kanälen, rhythmische Aktivität zu erzeugen, daher werden sie auch als „Schrittmacherkanäle“ bezeichnet. Sie sind den Schrittmacherkanälen im Körper des Menschen sehr ähnlich, wie sie beispielsweise im Sinusknoten des Herzens vorkommen. Schrittmacherkanäle steuern auch den rhythmischen Flagellenschlag von Seeigelspermien.
Clevere Eigenschaften passen das Ionenkanalsystem an Süßwasser an
Ein genauerer Blick auf Zebrafischspermien enthüllte eine Reihe auffälliger Merkmale, welche die neu entdeckten HCN-like 1-Kanäle besonders machen.
So leitet die „klassische“ Pore des Kanals, die PD, keine Ionen. Stattdessen passieren Ionen den Kanal über die Spannungssensordomäne (Abbildung 2, rechts). Die Forscher identifizierten innerhalb eines in der Zellmembran liegenden Segments der VSD eine Schlüsselaminosäure, Methionin, die hilft, Ionen über die Membran zu bringen.
Zweitens wird der Strom ausschließlich von positiven Teilchen, sog. Protonen, und nicht von anderen Ionen getragen. Protonen sind nur in winzigen Mengen in wässrigen Lösungen vorhanden. Protonenselektive Kanäle sind darauf spezialisiert, Protonen gegenüber anderen Ionen auszuwählen, die häufig zehn- bis hunderttausendfach häufiger vorkommen. Der neu entdeckte HCN-like 1-Kanal ist keine Ausnahme: Er bevorzugt Protonen gegenüber anderen Ionen um das 3-Millionenfache.
Die Beschränkungen üblicher HCN-Kanäle, welche in Süßwasser aufgrund der geringen Ionenzahl nicht funktionieren würden, werden durch die HCN-like 1-Kanäle geschickt ausgehebelt. Den falsch gerichteten Ionengradient in Süßwasser umgeht der Kanal, indem die hierfür übliche Pore geschlossen wird. Stattdessen wird ein Ionenweg für Protonen geschaffen, die dann die Funktion der anderen Ionen übernehmen können.
Die Forscherinnen und Forscher der Studie vermuten, dass der HCN-like 1-Kanal einem anderen Ionenkanals entgegenwirkt, der zuvor in Zebrafischspermien identifiziert wurde (2). So verhindert der Kanal, dass die Membranspannung zu negativ wird, wenn Spermien in Süßwasser freigesetzt werden. Damit hat HCN-like 1 die Funktion des verwandten „Schrittmacherkanals“ in Seeigelspermien bewahrt. Bisher findet sich die HCN-like-Unterfamilie in einer Reihe von Fischarten. Es gibt Hinweise, dass ein weiteres Mitglied der neu entdeckten Kanalfamilie in Haarzellen des Hörsystems und im Seitenliniensystem vorhanden sein könnte (3). Man darf gespannt sein, wohin die Erforschung dieser neuen Kanalfamilie führen wird.
Diese Newsmeldung wurde mit Material caesar - center of advanced european studies and research via Informationsdienst Wissenschaft erstellt.