Carbonylfluorid
- Seiten mit Skriptfehlern
- Wikipedia:Vorlagenfehler/Vorlage:GESTIS
- Wikipedia:Vorlagenfehler/Vorlage:Infobox Chemikalie
- Wikipedia:Wikidata-Wartung:PubChem fehlt lokal
- Wikipedia:Wikidata-Wartung:DrugBank fehlt lokal
- Giftiger Stoff bei Einatmen
- Ätzender Stoff
- Wikipedia:Wikidata-Wartung:CAS-Nummer fehlt lokal
- Organofluorverbindung
- Carbonylverbindung
- Gas
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
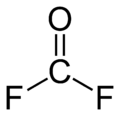
| ||||||||||
| Allgemeines | ||||||||||
| Name | Carbonylfluorid | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | CF2O | |||||||||
| Kurzbeschreibung |
farbloses, hygroskopisches Gas mit stechendem Geruch[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 66,01 g·mol−1 | |||||||||
| Aggregatzustand |
gasförmig | |||||||||
| Dichte | ||||||||||
| Schmelzpunkt |
−114,0 °C[1] | |||||||||
| Siedepunkt |
−84,6 °C[1] | |||||||||
| Löslichkeit |
Hydrolyse in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Carbonylfluorid ist die gebräuchlichste Bezeichnung für Kohlenoxiddifluorid, CF2O, das Difluorid der Kohlensäure. Es ist das Fluor-Analogon des Phosgens.
Eigenschaften
Carbonylfluorid ist ein giftiges, stechend riechendes Gas, das aufgrund seiner Hygroskopie an der Luft raucht. Es ist gut in organischen Lösungsmitteln löslich (beispielsweise Benzol, Toluol, Chlorbenzolen und anderen), es löst sich in Wasser unter rascher Zersetzung zu Kohlenstoffdioxid und Flusssäure, weshalb die organischen Lösemittel wasserfrei gemacht werden müssen, sollen diese zur Synthese oder zum Arbeiten mit Carbonylfluorid verwendet werden:
- $ \mathrm {COF_{2}+H_{2}O\longrightarrow CO_{2}+2\ HF} $
Entstehung
Carbonylfluorid entsteht meist als Zersetzungsprodukt fluorierter Kohlenwasserstoffe bei deren thermischer Zersetzung, beispielsweise aus Trifluormethanol oder Tetrafluormethan unter Anwesenheit von Wasser:
- $ \mathrm {CF_{4}+H_{2}O\longrightarrow COF_{2}+2\ HF} $
Es kann auch aus Kohlenstoffmonoxid und Fluor synthetisiert werden:[2]
- $ \mathrm {CO+F_{2}\longrightarrow COF_{2}} $
Verwendung
Carbonylfluorid ist als neues Ätzgas in der Halbleitertechnik und für die Reinigung von CVD-Reaktoren vorgeschlagen worden.[3] Im Labormaßstab kann es für Fluor-Synthesen verwendet werden, da es sehr leicht unter Abgabe der Fluoratome Sauerstoff aufnimmt und zu Kohlenstoffdioxid weiter reagiert.
Toxische Wirkung
Carbonylfluorid reizt bei inhalativer Aufnahme Haut, Augen und Atemwege. An Augen und Haut kommt es zu Schmerzen, Rötungen, schweren Verbrennungen und Sehbeeinträchtigungen durch Entziehen des Wassers aus dem Gewebe und zusätzlich durch den entstehenden Fluorwasserstoff. Bei einem Kontakt mit flüssigem Carbonylfluorid entstehen Erfrierungen. Nach längerer Aufnahme durch die Atemwege zeigt der Patient Halsschmerzen, Husten und Dyspnoe. Die Symptome können verzögert auftreten. Als schlimmste inhalatorische Folge kann ein toxisches Lungenödem auftreten. Dieses ist mit Cortison, auf jeden Fall auch präklinisch, zu therapieren.