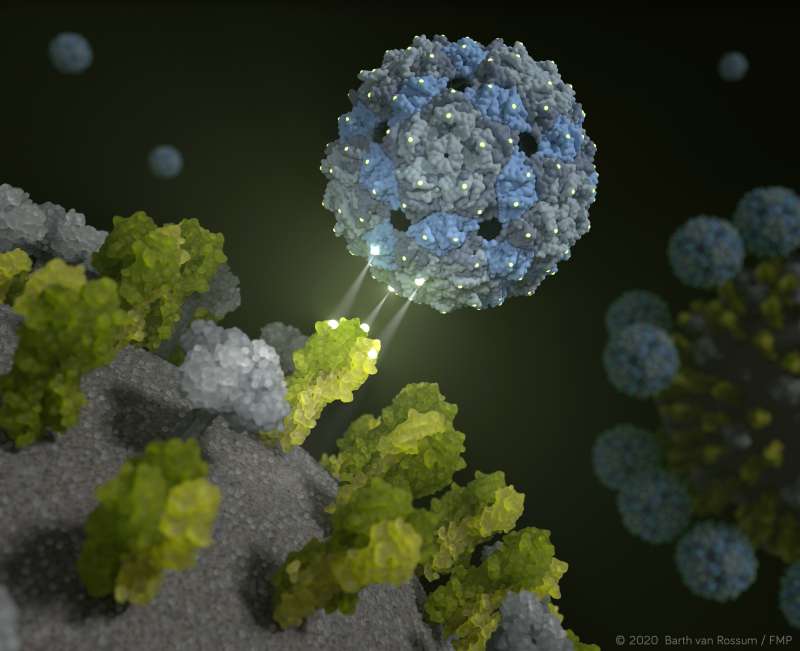
Phagen-Kapsid gegen Influenza: Passgenauer Inhibitor verhindert virale Infektion
Bio-News vom 30.03.2020
Berliner Forscher haben auf Basis einer leeren und damit nicht-infektiösen Hülle eines Phagen-Virus ein chemisch modifiziertes Phagen-Kapsid entwickelt, das den Influenzaviren sprichwörtlich die Luft zum Atmen nimmt. Durch Bindungsstellen werden die Influenzaviren so von den Phagen-Kapsiden umhüllt, dass sie die Lungenzellen praktisch nicht mehr infizieren können. Neben dem Leibniz-Forschungsinstituts für Molekulare Pharmakologie (FMP) sind die Freie Universität Berlin, die TU Berlin, die HU Berlin, das Robert Koch-Instituts (RKI) und die Charité-Universitätsmedizin Berlin beteiligt. Die Ergebnisse werden unmittelbar in der Coronavirus-Forschung genutzt werden.
Influenzaviren sind nach wie vor hoch gefährlich: Laut Schätzungen der Weltgesundheitsorganisation WHO sterben weltweit jedes Jahr bis zu 650.000 Menschen an der Grippe. Bisherige antivirale Medikamente sind nur bedingt wirksam, da sie das Grippevirus erst angreifen, wenn es die Lungenzellen bereits infiziert hat. Wünschenswert und weitaus effektiver wäre es, die Infektion von vornherein zu verhindern.
Genau das verspricht der neue Ansatz aus Berlin. Das von einem multidisziplinären Forscherteam entwickelte Phagen-Kapsid hüllt Grippeviren so maßgeschneidert ein, dass sie die Zellen gar nicht erst infizieren können. „Nach bisherigen präklinischen Tests können wir sowohl saisonale Influenzaviren als auch Vogelgrippeviren mit unserer chemisch modifizierten Phagenhülle unschädlich machen“, erläutert Prof. Dr. Christian Hackenberger, Leiter der Abteilung Chemische Biologie am Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) und Leibniz-Humboldt Professor für Chemische Biologie an der HU Berlin. „Das ist ein großer Erfolg, der völlig neue Perspektiven für die Entwicklung neuer antiviraler Medikamente bietet.“
Multiple Bindungen passen wie ein Klettband
Der neue Inhibitor macht sich eine Eigenschaft zu Nutze, den sämtliche Influenzaviren besitzen: Auf den Virus-Oberflächen befinden sich drei-bindige (trivalente) Rezeptoren, die sogenannten Hämagglutinin Proteine, die an Zuckermoleküle (Sialinsäuren) auf der Oberfläche von Zellen des Lungengewebes binden. Im Falle einer Ansteckung haken sich die Viren - ähnlich wie bei einem Klettverschluss – bei ihrem Opfer, den Lungenzellen, ein. Das Grundprinzip ist hier, dass diese Interaktionen nicht durch eine einzelne, sondern multiple Bindungen erfolgen.
Publikation:
Daniel Lauster et al.
Phage capsid nanoparticles with defined ligand arrangement block influenza virus entry.
Nature Nanotechnology
DOI: 10.1038/s41565-020-0660-2
Es war die Oberflächenstruktur der Grippeviren, welche die Forscher vor mehr als sechs Jahren zu folgender Ausgangsfrage inspirierte: Könnte man nicht einen Inhibitor entwickeln, der passgenau an die trivalenten Rezeptoren bindet und somit die Oberfläche der Lungengewebszellen vortäuschen kann?
Tatsächlich kann man das, wie man heute weiß, und zwar mit Hilfe eines harmlosen Darmbewohners: Der Q-beta-Phage besitzt perfekte Oberflächeneigenschaften und eignet sich hervorragend, um es mit Liganden – in diesem Falle Zuckermoleküle – als „Köder“ zu bestücken. Dafür reicht die leere Phagenhülle aus. „Unser multivalentes Gerüstmolekül ist nicht infektiös und besteht aus 180 identischen Proteinen, die genau den gleichen Abstand aufweisen wie die trivalenten Rezeptoren des Hämagglutinins auf der Virusoberfläche“, erklärt Dr. Daniel Lauster, ehemaliger Doktorand der AG Molekulare Biophysik (HU) und heute Postdoktorand an der Freien Universität Berlin. „Somit besitzt es ideale Ausgangsbedingungen, um das Grippevirus zu täuschen – oder genauer gesagt, um räumlich passgenau daran zu binden. Wir schalten das Grippevirus also mithilfe eines Phagen-Virus aus!“
Damit das Q-beta-Gerüst die gewünschte Aufgabe erfüllen kann, muss es erst chemisch modifiziert werden. Produziert an der TU Berlin aus E. coli-Bakterien, bringt die Arbeitsgruppe von Prof. Hackenberger am FMP und der HU Berlin mit Hilfe der Synthesechemie Zuckermoleküle an definierten Positionen der Virushülle an.
Virus wird getäuscht und eingehüllt
Dass die so aufgerüstete kugelförmige Struktur eine große Bindungsstärke und Hemmpotenzial besitzt, das wurde in etlichen Untersuchungen am Tiermodell und in Zellkulturen nachgewiesen. Das Robert Koch-Institut in Berlin ermöglichte es dieser Studie, auch das antivirale Potenzial der Phagen-Kapside gegen viele aktuelle Influenza Virusstämme und sogar gegen Vogelgrippeviren zu untersuchen. Sein therapeutisches Potenzial hat es sogar an menschlichem Lungengewebe bewiesen, wie die Forscherkollegen der Medizinischen Klinik für Infektiologie und Pneumologie der Charité zeigen konnten: Wurde das Gewebe mit Grippeviren infiziert und mit dem Phagen-Kapsid behandelt, konnten sich die Influenzaviren praktisch nicht mehr vermehren.
Gestützt werden die Ergebnisse durch einen strukturellen Nachweis, den Wissenschaftler der Freien Universität Berlin aus dem Forschungszentrum für Elektronenmikroskopie (FZEM) erbringen konnten: Hochauflösende Kryo-Elektronenmikroskopie und Kryo-Elektronentomographie zeigen direkt und vor allem räumlich, dass der Inhibitor das Virus vollständig einkapselt. Mit mathematisch-physikalischen Modellen wurde außerdem die Interaktion zwischen Influenzaviren und dem Phagen-Kapsid im Computer simuliert. „Unsere Computer-gestützten Berechnungen zeigen, dass der rational entworfene Inhibitor in der Tat an das Hämagglutinin bindet und das Influenzavirus komplett einhüllt“, bestätigt Dr. Susanne Liese von der AG Netz der Freien Universität Berlin. „Damit konnte die hohe Bindungsstärke auch mathematisch beschrieben und erklärt werden.“
Therapeutisches Potenzial muss weiter erforscht werden
Weitere präklinische Untersuchungen müssen nun folgen. Noch weiß man zum Beispiel nicht, ob das Phagen-Kapsid eine Immunantwort in Säugetieren provoziert. Bestenfalls könnte diese die Wirkung des Inhibitors noch verstärken. Möglich ist aber auch, dass eine Immunantwort die Wirksamkeit der Phagenkapside bei wiederholter Gabe herabsetzt oder dass die Grippeviren Resistenzen entwickeln. Und natürlich fehlt noch der Beweis, dass der Inhibitor auch im Menschen wirksam ist.
Doch die Berliner Forscher-Allianz bescheinigt dem Ansatz großes Potenzial. „Unser rational entwickelter, dreidimensionaler, multivalenter Inhibitor weist in eine neue Richtung hin zur Entwicklung strukturell anpassbarer Influenzavirusbinder. Das wurde so noch nie in der Multivalenzforschung erreicht“, betont Prof. Hackenberger. Biologisch abbaubar, nicht toxisch und in Zellkulturstudien nicht immunogen, lasse sich dieser Ansatz prinzipiell auch auf andere Viren und möglicherweise auch auf Bakterien anwenden, meint der Chemiker. Es liegt auf der Hand, dass die Autoren eine Anwendung ihres Ansatzes auf das aktuelle Coronavirus als ihre neue Herausforderung betrachten. Die Idee dabei ist, dass ein Wirkstoff entwickelt wird, der die Bindung von Coronaviren an die im Rachenraum und den nachfolgenden Atemwegen befindlichen Wirtszellen und somit deren Infektion verhindert.
Diese Newsmeldung wurde mit Material des Leibniz-Forschungsinstituts für Molekulare Pharmakologie (FMP) via Informationsdienst Wissenschaft erstellt.