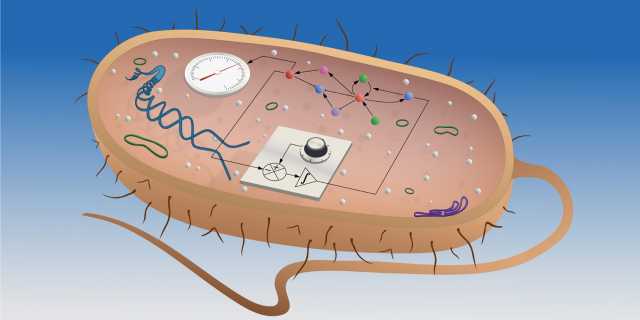
Systeme stabil halten
Bio-News vom 20.06.2019
Sowohl die Natur als auch die Technik sind auf integrierende Feedback-Mechanismen angewiesen. Sie sorgen dafür, dass Systeme stabil bleiben. ETH-Forschende haben nun mittels synthetischer Biologie einen solchen Mechanismus von Grund auf neuentwickelt und erstmals als künstliches Gen-Netzwerk in eine lebende Zelle eingebaut. Hilfreich ist das für die Zelltherapie in der Medizin und für die Biotechnologie.
Der menschliche Körper sorgt dafür, dass die Kalziumkonzentration im Blut konstant bleibt. Ebenso hält der Autopilot ein Verkehrsflugzeug auf konstanter Flughöhe. Diese beiden Beispiele haben Gemeinsamkeiten: Körper und Autopilot verwenden dazu ausgeklügelte, sogenannte integrierende Feedback-Mechanismen (siehe Kasten). Forschenden am Departement für Biosysteme der ETH Zürich in Basel ist es nun gelungen, einen solchen integrierenden Regelkreis erstmals in einer lebenden Zelle von Grund auf neu zu bauen, wie sie in der aktuellen Ausgabe der Zeitschrift Nature berichten.
Mit ihrem Ansatz der synthetischen Biologie könnte es in Zukunft unter anderem möglich werden, biotechnologische Produktionsprozesse zu optimieren und Patienten mit Hormonstörungen mittels Zelltherapie zu helfen.
Publikation:
Aoki SK, Lillacci G, Gupta A, Baumschlager A, Schweingruber D, Khammash M
A universal biomolecular integral feedback controller for robust perfect adaptation
Nature, 19. Juni 2019
DOI: 10.1038/s41586-019-1321-1
Trotz Umwelteinflüssen konstant
Erste technische Formen von integrierenden Feedback-Regelungen wurden vor über hundert Jahren von Schifffahrtsingenieuren entwickelt, um Schiffssteuerungen zu automatisieren. Seither kommt dieses Regelungsprinzip überall dort zum Einsatz, wo es darum geht, beispielsweise eine Richtung, Temperatur, Geschwindigkeit oder Höhe konstant und gegenüber äusseren Einflüssen stabil zu halten. Das Spezielle an einer integrierenden Regelung ist, dass die entsprechenden Korrekturen sowohl von der Höhe als auch der Dauer der Abweichung vom gewünschten Wert abhängig sind.
Auch in der Biologie sind während der Evolution Mechanismen entstanden, um zum Beispiel die Konzentration von Stoffen im Blut konstant zu halten. Dass es sich dabei ebenfalls um integrierende Regelkreise handelt, haben Forschende um Mustafa Khammash, Professor am Departement für Biosysteme, bereits vor einigen Jahren gezeigt. „Solche integrierenden Regelkreise sind äusserst resistent gegenüber unvorhergesehenen Umwelteinflüssen“, erklärt der ETH-Professor. „Dies dürfte erklären, warum sich das Prinzip in der Evolution durchgesetzt hat, und warum es in der Technik so oft angewandt wird.“
Zusammenspiel zweier Moleküle
Khammash und seinem interdisziplinären Team von Regelungstheoretikern, Mathematikern und Biologen ist es nun gelungen, einen solchen integrierenden Feedback-Regelkreis erstmals als synthetisches Gen-Netzwerk in einem Bakterium aufzubauen. Ihr Feedback-Mechanismus fusst auf zwei Molekülen – A und B –, die sich aneinanderheften und auf diese Weise inaktiviert werden. Diese beiden Moleküle sind in der Lage, die Konzentration eines dritten Moleküls C konstant zu halten: Das System ist so aufgebaut, dass das Molekül B die Produktion von C fördert und die Produktionsrate von A von der Konzentration von C abhängig ist. Die Feedback-Schleife: Ist viel C vorhanden, wird mehr A produziert und somit mehr B inaktiviert, wodurch weniger C produziert wird.
Im Rahmen eines Machbarkeitsnachweises nutzten die ETH-Wissenschaftler dieses Prinzip, um die Herstellung eines in Kolibakterien eingeschleusten grün fluoreszierenden Proteins zu steuern. Dank des Feedback-Regelkreises stellten die Bakterien ständig gleich viel des Fluoreszenzfarbstoffs her und zwar auch dann, als die Wissenschaftler zu Testzwecken mit Hemmstoffen die Produktion des Farbstoffs zu dämpfen versuchten. In einem zweiten Experiment gelang es den Forschenden, eine Bakterienpopulation herzustellen, die mit konstanter Rate wuchs, das sogar noch, als die Wissenschaftler das Wachstum zu Testzwecken zu stören versuchten.
Biotech und Therapien verbessern
Dereinst zum Einsatz kommen könnte der neue Regelmechanismus in der Biotechnologie bei Bakterien, mit welchen Vitamine, Medikamente, Chemikalien oder Biotreibstoffe hergestellt werden. Der Mechanismus könnte dabei verwendet werden, um die Produktionsrate der Bakterien konstant auf einem optimalen Niveau zu halten.
Die ETH-Wissenschaftler sind nun auch daran, einen vergleichbaren Regelmechanismus für Säugetierzellen zu entwickeln, was weitere Anwendungen ermöglichen könnte. Dazu gehören Designerzellen mit genetischen Netzwerken, die im Körper von Patienten Hormone produzieren. Profitieren könnten davon beispielsweise Menschen mit Diabetes oder einer Schilddrüsenunterfunktion. Auch könnte man die synthetischen Regelkreise nutzen, um die Immuntherapie von Krebs zu verbessern. „Bei dieser Therapieform müssen Immunzellen genügend aktiv sein, um den Tumor bekämpfen zu können, jedoch nicht überaktiv, wodurch sie gesundes Gewebe schädigen würden“, erklärt Khammash. „Mit einem Mechanismus wie dem unsrigen könnte man die Aktivität feinregulieren.“
Integrierender Regelkreis
Das Hormon Paratyrin wirkt im Körper als einer von zwei Feedback-Regulatoren: Paratyrin fördert die Mobilisierung von Kalzium aus dem Knochengewebe ins Blut. Je tiefer die Kalzium-Konzentration im Blut, desto mehr Paratyrin wird in den Nebenschilddrüsen produziert. „Auf diese Weise werden zu tiefe Kalzium-Werte teilweise ausgeglichen“, sagt Khammash.
Um die Konzentration auch nach grossen Ausschlägen gegen oben oder unten vollständig auf den Sollwert zurückzubringen, brauche es allerdings einen zweiten Mechanismus, erklärt Khammash. Diese Rolle übernimmt eine biologisch aktive Form von Vitamin D3, welche die Aufnahme von Kalzium aus dem Nahrungsbrei im Dünndarm ins Blut fördert. Die Produktion dieser aktiven Form von Vitamin D3 in den Nieren ist allerdings von der Paratyrin-Konzentration abhängig.
Gemeinsam sorgen die beiden Hormone dafür, dass die Blutkonzentration im zeitlichen Verlauf möglichst wenig und möglichst nur kurzzeitig von der Soll-Konzentration abweicht – oder mit anderen Worten: die „über die Zeit integrierte Abweichung“ konstant ist, wie es ein Mathematiker ausdrücken würde. Daher der Name integrierender Regelkreis.
Zusammenspiel zweier Moleküle
Khammash und seinem interdisziplinären Team von Regelungstheoretikern, Mathematikern und Biologen ist es nun gelungen, einen solchen integrierenden Feedback-Regelkreis erstmals als synthetisches Gen-Netzwerk in einem Bakterium aufzubauen. Ihr Feedback-Mechanismus fusst auf zwei Molekülen – A und B –, die sich aneinanderheften und auf diese Weise inaktiviert werden. Diese beiden Moleküle sind in der Lage, die Konzentration eines dritten Moleküls C konstant zu halten: Das System ist so aufgebaut, dass das Molekül B die Produktion von C fördert und die Produktionsrate von A von der Konzentration von C abhängig ist. Die Feedback-Schleife: Ist viel C vorhanden, wird mehr A produziert und somit mehr B inaktiviert, wodurch weniger C produziert wird.
Im Rahmen eines Machbarkeitsnachweises nutzten die ETH-Wissenschaftler dieses Prinzip, um die Herstellung eines in Kolibakterien eingeschleusten grün fluoreszierenden Proteins zu steuern. Dank des Feedback-Regelkreises stellten die Bakterien ständig gleich viel des Fluoreszenzfarbstoffs her und zwar auch dann, als die Wissenschaftler zu Testzwecken mit Hemmstoffen die Produktion des Farbstoffs zu dämpfen versuchten. In einem zweiten Experiment gelang es den Forschenden, eine Bakterienpopulation herzustellen, die mit konstanter Rate wuchs, das sogar noch, als die Wissenschaftler das Wachstum zu Testzwecken zu stören versuchten.
Biotech und Therapien verbessern
Dereinst zum Einsatz kommen könnte der neue Regelmechanismus in der Biotechnologie bei Bakterien, mit welchen Vitamine, Medikamente, Chemikalien oder Biotreibstoffe hergestellt werden. Der Mechanismus könnte dabei verwendet werden, um die Produktionsrate der Bakterien konstant auf einem optimalen Niveau zu halten.
Die ETH-Wissenschaftler sind nun auch daran, einen vergleichbaren Regelmechanismus für Säugetierzellen zu entwickeln, was weitere Anwendungen ermöglichen könnte. Dazu gehören Designerzellen mit genetischen Netzwerken, die im Körper von Patienten Hormone produzieren. Profitieren könnten davon beispielsweise Menschen mit Diabetes oder einer Schilddrüsenunterfunktion. Auch könnte man die synthetischen Regelkreise nutzen, um die Immuntherapie von Krebs zu verbessern. „Bei dieser Therapieform müssen Immunzellen genügend aktiv sein, um den Tumor bekämpfen zu können, jedoch nicht überaktiv, wodurch sie gesundes Gewebe schädigen würden“, erklärt Khammash. „Mit einem Mechanismus wie dem unsrigen könnte man die Aktivität feinregulieren.“
Integrierender Regelkreis
Das Hormon Paratyrin wirkt im Körper als einer von zwei Feedback-Regulatoren: Paratyrin fördert die Mobilisierung von Kalzium aus dem Knochengewebe ins Blut. Je tiefer die Kalzium-Konzentration im Blut, desto mehr Paratyrin wird in den Nebenschilddrüsen produziert. „Auf diese Weise werden zu tiefe Kalzium-Werte teilweise ausgeglichen“, sagt Khammash.
Um die Konzentration auch nach grossen Ausschlägen gegen oben oder unten vollständig auf den Sollwert zurückzubringen, brauche es allerdings einen zweiten Mechanismus, erklärt Khammash. Diese Rolle übernimmt eine biologisch aktive Form von Vitamin D3, welche die Aufnahme von Kalzium aus dem Nahrungsbrei im Dünndarm ins Blut fördert. Die Produktion dieser aktiven Form von Vitamin D3 in den Nieren ist allerdings von der Paratyrin-Konzentration abhängig.
Gemeinsam sorgen die beiden Hormone dafür, dass die Blutkonzentration im zeitlichen Verlauf möglichst wenig und möglichst nur kurzzeitig von der Soll-Konzentration abweicht – oder mit anderen Worten: die „über die Zeit integrierte Abweichung“ konstant ist, wie es ein Mathematiker ausdrücken würde. Daher der Name integrierender Regelkreis.
Diese Newsmeldung wurde via Informationsdienst Wissenschaft erstellt.