Thromboxansynthase
- Wikipedia:Vorlagenfehler/Vorlage:Cite journal/temporär
- Wikipedia:Proteinbild nicht vorhanden
- Isomerase
| Thromboxansynthase | ||
|---|---|---|
|
— | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 533 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Monomer, multipass Membranprotein | |
| Kofaktor | Häm | |
| Bezeichner | ||
| Gen-Namen | TBXAS1; CYP5A1 | |
| Externe IDs | OMIM: 274180 UniProt: P24557 | |
| Enzymklassifikation | ||
| EC, Kategorie | 5.3.99.5 Isomerase | |
| Reaktionsart | Umlagerung | |
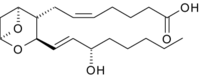
| Substrat | Prostaglandin H2 | |
| Produkte | Thromboxan A2 | |
| Vorkommen | ||
| Homologie-Familie | Thromboxansynthase | |
| Übergeordnetes Taxon | Chordatiere | |
Die Thromboxan-Synthase (TXAS) ist das Enzym, das die Umlagerung von Prostaglandin H2 zu Thromboxan A2 katalysiert. TXAS wird in Chordatieren produziert. Beim Menschen ist das Enzym in Thrombozyten, der Lunge, den Nieren, in der Milz und in Macrophagen zu finden. Das Reaktionsprodukt Thromboxan fördert die Verengung von Blutgefäßen und ist der natürliche Gegenspieler von Prostacyclin. Mutationen am TBXAS1-Gen können zu TXAS- und Thromboxanmangel, sowie zu einer (seltenen) Dysplasie führen.[1]
TXAS ist Target bei der Behandlung chronisch-entzündlicher Darmerkrankungen, sowie bei der Blasenkrebs-Behandlung, um die Menge der eingesetzten Chemotherapeutika zu reduzieren. Auch bei Darmkrebs und Prostatakrebs ist die TXAS-Produktion erhöht.[2][3][4][5]
Katalysierte Reaktion
Prostaglandin H2 wird zu Thromboxan A2 umgelagert. Die Reaktion ist selbstregulierend.[6]
Einzelnachweise
- ↑ UniProt P24557
- ↑ Howes LG, James MJ, Florin T, Walker C: Nv-52: a novel thromboxane synthase inhibitor for the treatment of inflammatory bowel disease. In: Expert Opin Investig Drugs. 16. Jahrgang, Nr. 8, August 2007, S. 1255–66, doi:10.1517/13543784.16.8.1255, PMID 17685873.
- ↑ Moussa O, Riker JM, Klein J, Fraig M, Halushka PV, Watson DK: Inhibition of thromboxane synthase activity modulates bladder cancer cell responses to chemotherapeutic agents. In: Oncogene. 27. Jahrgang, Nr. 1, Januar 2008, S. 55–62, doi:10.1038/sj.onc.1210629, PMID 17603559.
- ↑ Sakai H, Suzuki T, Takahashi Y, et al: Upregulation of thromboxane synthase in human colorectal carcinoma and the cancer cell proliferation by thromboxane A2. In: FEBS Lett. 580. Jahrgang, Nr. 14, Juni 2006, S. 3368–74, doi:10.1016/j.febslet.2006.05.007, PMID 16709411.
- ↑ Nie D, Che M, Zacharek A, et al: Differential expression of thromboxane synthase in prostate carcinoma: role in tumor cell motility. In: Am. J. Pathol. 164. Jahrgang, Nr. 2, Februar 2004, S. 429–39, PMID 14742249, PMC 1602253 (freier Volltext) – (amjpathol.org).
- ↑ Hall ER, Tuan WM, Venton DL: Production of platelet thromboxane A2 inactivates purified human platelet thromboxane synthase. In: Biochem. J. 233. Jahrgang, Nr. 3, Februar 1986, S. 637–41, PMID 3707514, PMC 1153079 (freier Volltext).
Weblinks
- Jassal/D'Eustachio/reactome.org: Thromboxane synthase (CYP5A1) mediates the isomerization of prostaglandin H2 to thromboxane A2