Toxoplasma gondii
| Toxoplasma gondii | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
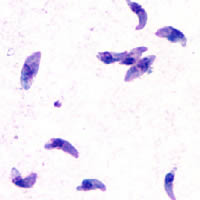
Tachyzoiten | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Toxoplasma gondii | ||||||||||||
| (Nicolle & Manceaux, 1908) |
Toxoplasma gondii (von altgr. Τόξο toxo ,Bogen' und πλάσμα plásma ‚Gebilde') ist ein bogenförmiges Protozoon mit parasitischer Lebensweise. Sein Endwirt sind Katzen, als Zwischenwirt dienen andere Wirbeltiere. Es ist der bislang einzige bekannte Vertreter der Gattung Toxoplasma. Der Parasit ist nahe verwandt mit Plasmodium, dem Erreger der Malaria, und mit Cryptosporidium.
Entdeckung und Forschungsgeschichte
Toxoplasma gondii wurde erstmalig 1907 in Tunesien als Parasit im Gundi (Ctenodactylus gundi) entdeckt und als Angehöriger der Apicomplexa identifiziert.[1] Aufgrund der Halbmondform wurde es von den Entdeckern Nicolle und Manceaux als Toxoplasma (griechisch Toxon, Bogen; griechisch Plasma, Gebilde) und aufgrund des Wirtstieres als Toxoplasma gondii benannt. Erst viel später konnte es auch beim Menschen als Krankheitserreger gefunden werden, die von ihm ausgelöste Krankheit wurde Toxoplasmose genannt. 1948 entwickelten Sabin und Feldmann einen serologischen Test auf der Basis von Antikörpern, den sie Dye-Test nannten.[2] Mit Hilfe dieser Methode konnte festgestellt werden, dass Toxoplasma gondii weltweit verbreitet ist und beim Menschen sehr häufig vorkommt.
Verbreitung
Der Parasit ist weltweit verbreitet, die Bevölkerung weist eine hohe Durchseuchung auf, da die Infektion meist ohne Symptome verläuft. Etwa 60 % der Bevölkerung in Deutschland besitzt Antikörper gegen Toxoplasma gondii, waren also bereits einmal mit dem Parasiten infiziert. Die Prävalenz (Krankheitshäufigkeit) steigt pro Lebensjahr um etwa 1 %. Nach Schätzungen erleiden 7 von 1.000 Schwangeren eine Infektion. Nach der Infektion besteht eine lebenslange Immunität, wenn das Immunsystem nicht erkrankt ist.
Merkmale
Toxoplasma gondii unterscheidet sich je nach Stadium sowohl in der Form als auch in der Größe. Die Zellen der freien und infektiösen Form sind in flüssigen Medien oder Frischpräparaten bogenförmig und erreichen Größen von zwei bis fünf Mikrometern. Betrachtet man sie in Gewebeproben oder fixierten Schnitten, erscheinen sie dagegen eiförmig oval. Außerdem können sie sowohl einzeln als auch zu mehreren in so genannten Pseudozysten im Gewebe vorkommen.
Die Oozysten messen bis zu 11 Mikrometer, die Gewebszysten bis zu 300 Mikrometer. Es bilden sich 2 verschiedene Populationen von Sporozoiten, die Tachyzoiten bilden sich nach dem Eindringen in den Zwischenwirt und vermehren sich dort rapide. Später treten Bradyzoiten auf, deren Vermehrung stark verlangsamt ist. Strukturell unterscheiden sich diese beiden Formen nicht.
Entwicklungszyklus
Die Oozysten werden vom Endwirt (Katzenartige) mit dem Kot ausgeschieden und gelangen so in den Zwischenwirt. Sie enthalten zwei Sporozysten mit je vier Sporozoiten. Sie können sehr lange (bis fünf Jahre) infektiös bleiben und überstehen Frost, sind jedoch nicht sehr hitzeresistent. Im Zwischenwirt (Wirbeltiere z.B. Vögel) schlüpfen die Sporocysten, diese dringen nun aktiv in kernhaltige Zellen des Zwischenwirtes ein (vor allem Lymphknoten, Retikuloendotheliales System). Nun setzt eine Vermehrung durch ungeschlechtliche Teilung ein, bei der sich zwei Tochterzellen von der Mutterzelle ablösen, wobei die Mutterzelle sich auflöst (Endodyogenie). Dieser Vorgang läuft nun so lange ab, bis die Wirtszelle komplett ausgefüllt ist und aufplatzt, so dass die Tachyzoiten (griech. tachys = schnell) frei werden. Dieser Vorgang wiederholt sich jetzt alle 6 Stunden. Nun breiten sich die Tachyzoiten im Blut aus und gehen so auch über die Plazenta ins Blut der Nachkommen über. Nachdem die Wirtsabwehr eingesetzt hat, verlangsamt sich die Teilungsdauer und man spricht nun von Bradyzoiten (griech. bradys = langsam). Es bilden sich in den Zellen Gewebezysten, die vor allem in der Muskulatur, aber auch im Gehirn oder in der Netzhaut des Auges latent überdauern. In dieser Form werden sie dann wiederum von der Katze, die den Zwischenwirt frisst, aufgenommen. Die Bradyzoiten werden nun im Darm frei und dringen in die Epithelzellen ein. Dort findet eine Schizogonie (ungeschlechtliche Fortpflanzung) statt und/oder es werden Makrogamonten und Mikrogamonten gebildet. Die Makrogamonten bilden Makrogameten (vergleichbar mit einer Eizelle) aus, während ein Mikrogamont Mikrogameten ausbildet (vergleichbar mit Spermien). Der Makrogamet wird von einem Mikrogameten befruchtet und es kommt zur Ausbildung einer Zygote (diploid), welche dann zu einer unsporulierten Oocyste reift. Diese wird nun mit dem Kot ausgeschieden und reift in der Außenwelt in 2–4 Tagen unter Sauerstoffeinfluss zu infektionsfähigen sporolierten Oozysten heran. Sie ist bis zu 5 Jahre infektionsfähig. Falls die Oozysten nun von Katzen aufgenommen werden, so entwickeln sich Tachyzoiten, Bradyzoiten und Gewebecysten. Diese verbleiben jedoch nur zu einem geringen Teil im Gewebe und wandern in das Darmepithel der Katze ein, wo sie erneut durch Schizogonie und Gamogonie Oozysten ausbilden. Der Lebenszyklus wird in drei Phasen unterteilt, 1. in die extraintestinale Phase, 2. in die externe Phase, 3. in die enteroepitheliale Phase.
Schadwirkung
Beim Menschen ruft dieser Parasit die Krankheit Toxoplasmose hervor. Er kann T. gondii in beiden Formen aufnehmen, sowohl als Zysten in halb rohem Fleisch oder als Schmierinfektion mit Katzenkot. Er übernimmt dann die Rolle des Zwischenwirtes, das heißt die Erreger durchdringen die Darmwand, um so in der Muskulatur, aber auch in anderen Organen Zysten zu bilden, die lebenslang überdauern. Die meisten Menschen machen irgendwann einmal diese Infektion durch, sie bleibt meistens ohne Symptome. Es kann einige Monate lang zu grippeähnlichen Beschwerden wie Fieber, Gelenk- und Muskelschmerzen und beispielsweise Lymphknotenschwellungen kommen. Bei Nagetieren konnten durch Toxoplasma verursachte Verhaltensänderungen nachgewiesen werden (so verlieren infizierte Tiere ihre Scheu gegenüber dem Geruch von Katzen, was dem Lebenszyklus von Toxoplasma förderlich wäre).[3] Beim Menschen möglicherweise durch Toxoplasmainfektion verursachte Verhaltensänderungen werden immer wieder diskutiert.[4][5][6][7]
Vorbeugung
Schwangere sollten kein Fleisch essen, das nicht durchgebraten ist und möglichst nicht mit Katzenkot umgehen und nicht im Garten arbeiten. Notfalls schützen Handschuhe oder Händewaschen vor den Mahlzeiten. Es ist sinnvoll, wenn eine andere Person das Katzenklo täglich reinigt, weil die Oozysten erst frühestens zwei Tage nach Ausscheidung infektiös werden.
Diagnostik
Eine Infektion lässt sich normalerweise am leichtesten durch immunologische Testverfahren (ELISA, Immunfluoreszenztest, ISAGA) nachweisen, also Nachweis von spezifischen Antikörpern. Dabei sprechen IgM - Antikörper für eine frische Infektion, IgM- und IgG- Antikörper zusammen für eine Infektion innerhalb der letzten eineinhalb Jahre. Liegen sowohl IgG- als auch IgM-Antikörper vor hilft ein sogenannter Aviditätstest beim Ausschluss einer frischen Infektion.
Es stehen auch molekularbiologische Untersuchungen (PCR) zur Verfügung. Sie eignen sich zur Untersuchung von Fruchtwasser zum Nachweis einer bereits erfolgten Übertragung auf das ungeborene Kind. Eine Schädigung des Kindes kann man durch Ultraschall diagnostizieren. Auch bei immungeschwächten Patienten eignet sich am ehesten die PCR oder Sichtbarmachung bereits entstandener größerer Läsionen mittels bildgebender Verfahren (CT, MRT).
T. gondii gehört zu den Infektionen, auf die man bei Schwangeren routinemäßig testen sollte, ähnlich wie Röteln, Syphilis, Hepatitis B, Chlamydien, HIV, eventuell Zytomegalie und Herpes. Die Untersuchung ist in Deutschland jedoch nicht Bestandteil der normalen Schwangerenvorsorge. Wenn schon früher einmal eine Infektion auf T. gondii nachgewiesen wurde, geht davon keine Gefahr mehr aus. Das ungeborene Kind ist dann während der Schwangerschaft durch die mütterlichen Antikörper vor einer Infektion geschützt.
Die Diagnose kann sehr schwierig werden, wenn sie im Nachhinein bei einem Neugeborenen gestellt werden muss, das erst spät Krankheitszeichen zeigt (beispielsweise Erblindung durch Chorioretinitis).
Therapie
Eine Erstinfektion mit T. gondii während der Schwangerschaft muss mit Antibiotika behandelt werden. Ansonsten kann eine Behandlung sinnvoll sein, wenn der Patient Symptome zeigt. Bewährt hat sich die Kombination Pyrimethamin zusammen mit einem Sulfonamid oder Clindamycin. Vor der 18. Schwangerschaftswoche wird alternativ ein Makrolidantibiotikum, z.B. Spiramycin, verabreicht, da dieses - im Gegensatz zu erstgenannten - keine Fehlbildungen beim ungeborenen Kind auslöst. Allerdings ist man nicht sicher, wie wahrscheinlich eine Übertragung während der Frühschwangerschaft überhaupt ist. Eventuell sollte das Kind nach der Geburt noch einige Zeit nachbehandelt werden. Alles in allem kann eine Schädigung des Kindes durch diesen sehr häufigen Parasiten also meistens verhindert werden.
Rechtliches
- Deutschland: Infektionsschutzgesetz - § 7 Abs. (3) - Unfallversicherungs-Einordnungsgesetz § 202 - Meldepflicht nur bei konnatalen Infektionen, Biostoffverordnung - Risikogruppe 2 (§10, §11, §13, §15), Mutterschutzgesetz - Allgemein.
- Fälle von Konnataler Infektion sind dem Robert Koch Institut zu melden. Weiter sind erkannte Infektionen nach dem Arbeitsschutzgesetz dem für den medizinischen Arbeitsschutz zuständigen oder dem Unfallversicherungsträger zu melden. Toxoplasma ist entsprechend Biostoffverordnung ein biologischer Arbeitsstoff der Risikogruppe 2. Nach dem Mutterschutzgesetz dürfen werdende oder stillende Mütter nicht mit möglichen Infektionsträgern arbeiten.
- Österreich: Infektionsschutzgesetz, Verordnung Biologische Arbeitsstoffe Risikogruppe 2, Mutterschutzgesetz, Mutter-Kind-Pass
- Schweiz: Infektionsschutzgesetz
Einzelnachweise
- ↑ Nicolle & Manceaux: Sur un protozoaire nouveau du gondi (Toxoplasma n. sp.) Arch Inst Pasteur Tunis 1909; 2:97
- ↑ * A. Sabin &Feldman: Dyes as microchemical indicators of a new immunity phenomenon affecting a protozoon parasite (Toxoplasma). Science 1948;108: 660
- ↑ Vyas et al.: Behavioral changes induced by Toxoplasma infection of rodents are highly specific to aversion of cat odors. Proc Natl Acad Sci U S A. 2007;104(15):6442-7. PMID 17404235 Volltext
- ↑ Gottfried Schatz: Jenseits der Gene - Zürich : Verlag Neue Zürcher Zeitung, 2008, 1. Kapitel: Unheimliche Gäste. Können Parasiten unsere Persönlichkeit verändern? NZZ-Online
- ↑ Lafferty: Can the common brain parasite, Toxoplasma gondii, influence human culture? Proc Biol Sci. 2006 Nov 7;273(1602):2749-55. PMID 17015323 Volltext
- ↑ zeit.de: Parasiten: Ferngesteuert, Zugriff am 3. Juli 2010
- ↑ Florian Rötzer: Der Parasit, der auch das Verhalten von Menschen beeinflussen könnte [1]
Weblinks
- Konsiliarlabor in Deutschland
- Merkblatt des Robert Koch Institutes
- www.wissenschaft.de: Toxoplasma gondii steht auf Jungs - Mit dem Parasiten infizierte Mütter bekommen häufiger männlichen Nachwuchs
- www.wissenschaft.de: Sardellen verbreiten Toxoplasmose in den Ozeanen
- „Parasit könnte menschliches Verhalten steuern“ - spekulativer Artikel auf spiegel.de
- Der Parasit, der das Verhalten seines Wirts verändert (Telepolis, 5. November 2011)
- Parasites in Humans: Toxoplasma Gondii
- "Toxoplasmose: Parasiten könnten das Suizidrisiko erhöhen" - spekulativer Artikel
- Toxoplasmosis - Recent advances, Open access book published in September 2012
