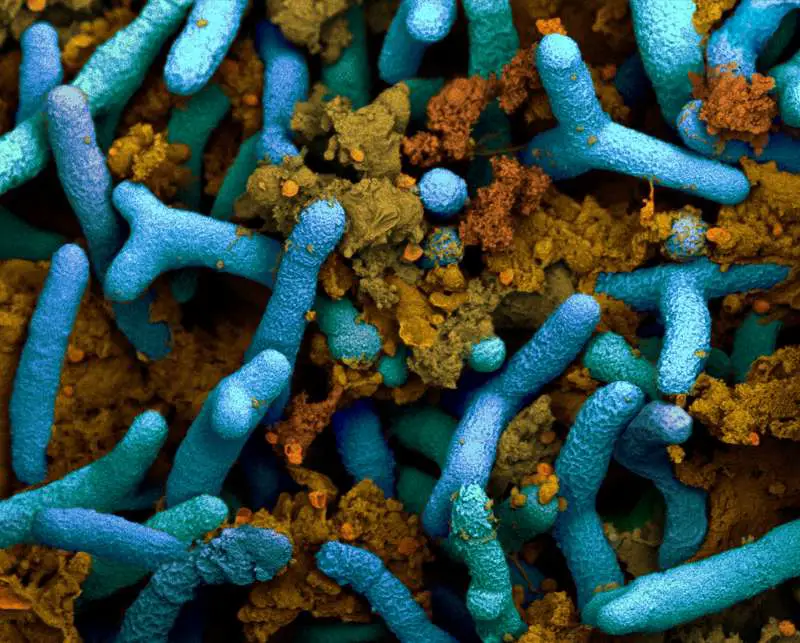
Wie Bakterien Soja düngen
Bio-News vom 03.06.2020
Soja und Klee haben in ihren Wurzeln eigene Düngerfabriken – Bakterien stellen dort das für die Pflanzen wichtige Ammonium her. Obschon dies schon seit Langem bekannt ist, haben Wissenschaftler den Wirkungsmechanismus erst jetzt im Detail beschrieben. Das könnte nun helfen, mit Biotechnologie die Landwirtschaft nachhaltiger zu gestalten.
Pflanzen benötigen Stickstoff in Form von Ammonium, um wachsen zu können. Bei sehr vielen Kulturpflanzen müssen Landwirte dieses Ammonium als Dünger aufs Feld führen. Dessen Herstellung ist energieintensiv und teuer, und bei der heutigen Produktionsweise wird viel CO2 freigesetzt. Einige wenige Ackerpflanzen besorgen sich den Ammoniumnachschub allerdings selbst: In den Wurzeln von Bohnen, Erbsen, Klee und anderen Hülsenfrüchtlern leben Bakterien, welche den Stickstoff aus der Luft in Ammonium umwandeln können.
Die Pflanzen und die sogenannten Knöllchenbakterien profitieren beide, und bisher war die wissenschaftliche Sicht auf diese Symbiose recht simpel: Die Pflanze bezieht von den Bakterien Ammonium, und die Bakterien erhalten im Gegenzug von der Pflanze kohlenstoffreiche Karbonsäuremoleküle.
Komplexeres Zusammenspiel als angenommen
ETH-Forschende unter der Leitung von Beat Christen, Professor für experimentelle Systembiologie, und Matthias Christen, Wissenschaftler am Institut für molekulare Systembiologie, konnten nun zeigen, dass das Zusammenspiel von Pflanze und Bakterien komplexer ist: Die Bakterien beziehen von der Pflanze neben dem Kohlenstoff auch die stickstoffreiche Aminosäure Arginin.
Publikation:
Flores-Tinoco CE, Tschan F, Fuhrer T, Margot C, Sauer U, Christen M, Christen B
Co-catabolism of arginine and succinate drives symbiotic nitrogen fixation
Molecular Systems Biology 2020
DOI: 10.15252/msb.199419
„Obschon die Stickstofffixierung der Knöllchenbakterien seit vielen Jahrzehnten untersucht wird, war das Wissen unvollständig“, sagt Beat Christen. „Unsere neuen Erkenntnisse werden es ermöglichen, die Abhängigkeit der Landwirtschaft vom Ammoniumdünger zu verringern und damit die Landwirtschaft nachhaltiger zu gestalten.“
Die Forschenden untersuchten und entschlüsselten die Stoffwechselwege von Knöllchenbakterien, die mit Klee und Soja zusammenleben, mit Methoden der Systembiologie. Zusammen mit ETH-Professor Uwe Sauer überprüften sie die Ergebnisse in Wachstumsexperimenten von Pflanzen und den Bakterien im Labor. Die Wissenschaftler vermuten, dass die neuen Erkenntnisse nicht nur für Klee und Soja gelten, sondern dass die Stoffwechselwege bei den anderen Hülsenfrüchtlern ähnlich ablaufen.
Eher ein Kampf als Freiwilligkeit
Die Erkenntnisse liefern eine neue Sicht auf die Koexistenz von Pflanzen und Knöllchenbakterien. „Anders als häufig dargestellt, ist diese Symbiose nicht geprägt von einem freiwilligen Geben und Nehmen. Vielmehr nutzen sich die beiden Partner aus, wo es nur geht“, sagt Matthias Christen.
Wie die Wissenschaftler zeigen konnten, legen Soja und Klee ihren Knöllchenbakterien nicht den roten Teppich aus, sondern empfangen sie wie einen Krankheitserreger: Die Pflanzen versuchen den Bakterien den Sauerstoff abzudrehen und setzen sie einem sauren Umfeld aus. Die Bakterien rackern sich ab, um in diesem unwirtlichen Milieu zu überleben. Sie nutzen das Arginin der Pflanzen, weil sie dank diesem auf einen Stoffwechsel umstellen können, für den sie nur wenig Sauerstoff benötigen.
Um die saure Umgebung zu neutralisieren, übertragen die Mikroben sauermachende Protonen auf Stickstoffmoleküle aus der Luft. Dadurch entsteht Ammonium, welches sie sich vom Hals schaffen, indem sie es aus der Bakterienzelle schleusen und somit an die Pflanze geben. „Das für die Pflanze so wertvolle Ammonium ist für die Bakterien also bloss ein Abfallprodukt aus ihrem Überlebenskampf“, sagt Beat Christen.
Die Umwandlung von molekularem Stickstoff in Ammonium ist nicht nur für die Industrie energieintensiv, sondern auch für die Knöllchenbakterien. Der neu beschriebene Mechanismus erklärt, warum die Bakterien so viel Energie aufwenden: Er ermöglicht ihnen zu überleben.
Mit Biotechnologie zu nachhaltiger Landwirtschaft
Das neue Wissen wird man in der Landwirtschaft und in der Biotechnologie nutzen können, um die bakterielle Stickstofffixierung auf Kulturpflanzen, die keine Hülsenfrüchtler sind, zu übertragen, also zum Beispiel auf Weizen, Mais oder Reis. Wissenschaftler haben das zwar schon mehrfach versucht – weil ein wichtiges Puzzleteil des Stoffwechsels bisher nicht bekannt war allerdings nur mit bescheidenem Erfolg. „Jetzt, wo wir den Mechanismus im Detail entschlüsselt haben, dürften die Chancen steigen, diesen Ansatz zu einem erfolgreichen Ende zu führen“, sagt Beat Christen.
Es ist denkbar, alle für den Stoffwechselweg nötigen Gene mit biotechnologischen Verfahren direkt in die Kulturpflanzen einzufügen. Ein anderer Ansatz wäre, diese Gene in Bakterien zu übertragen, die mit den Wurzeln von Weizen oder Mais wechselwirken. Diese Bakterien wandeln derzeit keinen Stickstoff aus der Luft in Ammonium um; biotechnologisch könnte man ihnen dazu verhelfen. Diesen Ansatz werden auch die ETH-Forschenden nun weiterverfolgen.
Diese Newsmeldung wurde mit Material ETH Zürich via Informationsdienst Wissenschaft erstellt.