Fettsäuresynthese
- Wikipedia:Vorlagenfehler/Vorlage:BibISBN
- Biologischer Prozess
- Biochemische Reaktion
- Stoffwechselweg
| Übergeordnet | ||
| Lipidbiosynthese Metabolismus der Fettsäuren | ||
| Gene Ontology | ||
|---|---|---|
| QuickGO | ||
Die biologische Fettsäuresynthese, auch als Lipogenese bezeichnet, verläuft durch sukzessiven Anbau von Malonyl-CoA an ein initiales Acetyl.
Im Gegensatz zum Abbau der Fettsäuren, der β-Oxidation, der sich in der Mitochondrienmatrix abspielt, findet deren Aufbau bei Tieren und Pilzen im Cytosol statt.
Fettsäuresynthese bei Pflanzen
Bei Pflanzen läuft die Fettsäurensynthese nur in den Plastiden ab, bei grünen Pflanzenzellen in den Chloroplasten, sonst in den Chromoplasten, Leucoplasten oder Proplastiden. Es laufen dieselben Reaktionen wie im Cytosol ab, jedoch werden nur Fettsäuren bis C18 synthetisiert. Diese können maximal eine Doppelbindung durch eine lösliche Desaturase des Stromas erhalten. Nach Transport ins glatte Endoplasmatische Retikulum erfolgt die Kettenverlängerung, im sER können durch membrangebundene Desaturasen weitere Doppelbindungen eingebaut werden. Der Abbau der Fettsäuren erfolgt bei Pflanzen nicht in den Mitochondrien, sondern nur in Peroxisomen.
Langkettige Fettsäuren sind in Pflanzen der Ausgangspunkt für die Biosynthese von Wachs und Cutin, welche beide für den Schutz vor der Umgebung unentbehrlich sind.
Allgemeiner Reaktionsablauf
Für die genaue Biosynthese inklusive Strukturformeln siehe Abschnitt Weblinks
Bemerkenswert ist, dass die im Aufbau befindliche Fettsäure bei Säugetieren und Pilzen bis zur endgültigen Fertigstellung an einem multifunktionellen Enzym, der sogenannten Fettsäure-Synthase[1], gebunden bleibt, die alle sieben Enzymfunktionen trägt. Sie besitzt eine periphere (distale) SH-Gruppe und eine zentrale (proximale) SH-Gruppe an einer Untereinheit des Komplexes, der Acyl-Carrier-Protein-Domäne (ACP). Die einzelnen Enzymfunktionen und ACP sind bei Pflanzen und Bakterien auf verschiedene Proteine verteilt, die sich zu einem Proteinkomplex zusammenlagern. Ebenso existiert bei allen Eukaryoten ein zweiter Fettsäuresyntheseweg in den Mitochondrien, bei welchem die Enzymaktivitäten auf Einzelproteine verteilt sind.[2]
Die Reaktionsfolge läuft wie folgt ab:
- 1) Acetyl-CoA entsteht in mehreren Prozessen, hauptsächlich durch oxidative Decarboxylierung von Pyruvat in der Glykolyse, durch Abbau von Aminosäuren oder durch β-Oxidation von Fettsäuren, dem umgekehrten zum hier dargestellten Prozess
- 2)

- Carboxylierung (Anlagerung von CO2) von freiem Acetyl-CoA zu Malonyl-CoA außerhalb des Komplexes durch die Acetyl-CoA-Carboxylase (mit der prosthetischen Gruppe Biotin)
- 3) $ \mathrm {Malonyl{\text{-}}CoA+ACP{\text{-}}SH{\xrightarrow[{ACP-S-Malonyltransferase}]{}}CoA{\text{-}}SH+Malonyl{\text{-}}ACP} $
- Bindung des Malonyl-CoA an die Acyl-Carrier-Protein-Domäne durch die Malonyl-Transferase[3], dabei wird Coenzym A wieder abgespalten
- 4)

- Acetylrest kondensiert unter Abspaltung von CO2 mithilfe der Ketoacyl-Synthase[4] an den Malonylrest, es bildet sich eine Acetoacetylgruppe (C4) an der proximalen SH-Gruppe; mit jeder der acht „Zyklen“, die die Reaktion durchläuft, bekommt dieses Zwischenprodukt mehr C-Atome (hat folglich auch einen anderen Namen). In Pflanzen und Bakterien kann auch ein anderes Enzym die Kette verlängern, das Acetyl-CoA direkt als Substrat benutzt (KAS III, EC 2.3.1.180)
- 5)
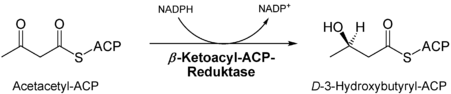
- Reduktion der Keto-Gruppe des Ketoacylrests an C3 durch die Ketoacyl-ACP-Reduktase[5], das Produkt ist ein Hydroxyacylrest
- 6)

- Dehydratisierung des Hydroxyacylrests durch die Hydroxyacyl-ACP-Dehydratase[6] zwischen C2 und C3
- 7)
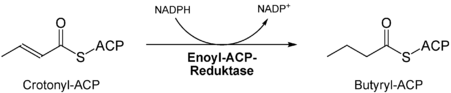
- Zweite Reduktion der Doppelbindung durch die Enoyl-ACP-Reduktase[7]
- 8) Anlagerung von Malonyl-CoA an die ACP-Domäne (=Schritt 3), anschließend sechsmalige Wiederholung des Zyklus und damit Verlängerung des Acylrests an der proximalen SH-Gruppe
- 9) Palmitinsäure, C16 wird durch eine Acyl-Hydrolase freigesetzt und dissoziiert sofort zu Palmitat
Dieser Vorgang wiederholt sich bis zur Fertigstellung, wobei meistens Palmitinsäure durch eine Thiolase hydrolytisch abgespalten wird. Hierbei ist zu beachten, dass die Fettsäure zunächst frei vorliegt. Das Schlüsselenzym der Fettsäuresynthese ist die Acetyl-CoA-Carboxylase, die sowohl allosterisch als auch hormonell reguliert wird.
Die Kettenverlängerung der Fettsäuren wird in der Pflanze durch Elongasen katalysiert.
Dieser Stoffwechselweg spielt unter gewöhnlichen Nahrungsbedingungen jedoch eine geringe Rolle, da durch die Nahrung bereits genügend Fette aufgenommen werden. Infolgedessen besteht nicht die Notwendigkeit, aus Kohlenhydraten Fettsäuren aufzubauen. Bei Tieren hat die Fettsäuresynthese noch eine größere Rolle, da diese z. B. eine erhebliche Fettreserve für den Winter bilden müssen.
Ungeradzahlige Fettsäuren
Fettsäureketten mit ungerader Anzahl von Kohlenstoffatomen entstehen, wenn Propionyl-CoA anstelle von Acetyl-CoA als Startmolekül dient. Die Kettenverlängerung findet dann, wie schon bei den geradzahligen Fettsäuren beschrieben, durch sukzessive Reaktionen mit Malonyl-CoA statt.[8]
Verzweigtkettige Fettsäuren
Verzweigungen am Alkyl-Ende der Fettsäure ergeben sich, wenn die Synthese mit einem verzweigten Molekül beginnt. Dabei spricht man beim Vorhandensein einer zusätzlichen Methylgruppe am vorletzten Kohlenstoffatom der Hauptkette von einer iso-Fettsäure und am vorvorletzten von einer anteiso-Fettsäure. Iso-Fettsäuren entstehen, wenn die Synthese mit Isovaleryl-CoA oder Isobutyryl-CoA beginnt. Diese Verbindungen leiten sich von den verzweigtkettigen Aminosäuren Leucin beziehungsweise Valin ab. Dagegen entsteht durch den Synthesestart mit 2-Methylbutyryl-CoA, das sich von Isoleucin ableitet, eine anteiso-Fettsäure. Weiter innerhalb der Fettsäurekette können aber ebenfalls Methyl-Verzweigungen während der Synthese erzeugt werden. Das geschieht, wenn die Kettenverlängerung nicht mit Malonyl-CoA, sondern mit Methylmalonyl-CoA durchgeführt wird.[8]
Für etliche Bakterienarten wie die Mykobakterien ist die Synthese von verzweigtkettigen Fettsäuren von großer Bedeutung, da Kettenverzweigungen eine Möglichkeit zur Regulierung der Membranfluidität darstellen. Die Biosynthese der längsten natürlichen Fettsäuren, der Mykolsäuren ist so umfangreich, dass er hier nicht detailliert dargestellt werden kann.[9]
Siehe auch
- Fettsäureabbau (Beta-Oxidation)
Quellen
- ↑ EC 2.3.1.85 (Fettsäure-Synthase (MEC)).
- ↑ J. K. Hiltunen u.a.: Mitochondrial fatty acid synthesis and respiration. In: Biochimica et biophysica acta Band 1797, Nummer 6–7, 2010 Jun-Jul, S. 1195–1202. doi:10.1016/j.bbabio.2010.03.006. PMID 20226757. (Review).
- ↑ EC 2.3.1.39 (ACP-S-Malonyltransferase).
- ↑ EC 2.3.1.41 (β-Ketoacyl-ACP-Synthase I).
- ↑ EC 1.1.1.100 (3-Ketoacyl-ACP-Reduktase).
- ↑ EC 4.2.1.61 (3-Hydroxypalmitoyl-ACP-Hydratase).
- ↑ EC 1.3.1.10 (Enoyl-ACP-Reduktase).
- ↑ 8,0 8,1 Der BibISBN-Eintrag Vorlage:BibISBN/3540574204 ist nicht vorhanden. Bitte prüfe die ISBN und lege ggf. einen Vorlage:Neuer Abschnitt an.
- ↑ T. Kaneda: Iso- and anteiso-fatty acids in bacteria: biosynthesis, function, and taxonomic significance. In: Microbiol. Rev. 55(2); June 1991: S. 288-302, PMID 1886522 (freier Volltextzugang).
Literatur
- Der BibISBN-Eintrag Vorlage:BibISBN/3131308834 ist nicht vorhanden. Bitte prüfe die ISBN und lege ggf. einen Vorlage:Neuer Abschnitt an.
- Der BibISBN-Eintrag Vorlage:BibISBN/3827413036 ist nicht vorhanden. Bitte prüfe die ISBN und lege ggf. einen Vorlage:Neuer Abschnitt an.
- Eduard Strasburger (Begr.), Peter Sitte, Elmar Weiler, Joachim W. Kadereit, Andreas Bresinsky, Christian Körner: Lehrbuch der Botanik für Hochschulen. 35. Auflage. Spektrum Akademischer Verlag, Heidelberg 2002, ISBN 3-8274-1010-X.
Weblinks
- Wikibooks: Biosynthese gesättigter Fettsäuren – Lern- und Lehrmaterialien
- Animation des Reaktionsablaufs
- Gopinathrao/reactome.org: Fatty Acyl-CoA Biosynthesis