Hydroxymethylglutaryl-CoA-Lyase
- Wikipedia:Vorlagenfehler/Vorlage:Cite journal/temporär
- Seiten mit defekten Dateilinks
- Lyase
| Hydroxymethylglutaryl-CoA-Lyase | ||
|---|---|---|
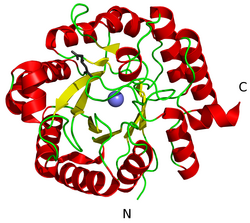
| Modellstruktur der menschlichen HMG-CoA-Lyase nach PDB 2cw6. Abgebildet ist ein Monomer, das enthaltende Magnesium(II)ion ist in blau dargestellt. | ||
| Vorhandene Strukturdaten: 2cw6 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 298 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Bezeichner | ||
| Gen-Name | HMGCL | |
| Externe IDs | OMIM: 246450 UniProt: P35914 | |
| Enzymklassifikation | ||
| EC, Kategorie | 4.1.3.4 Lyase | |
| Reaktionsart | Spaltung einer C-C-Bindung | |
| Substrat | HMG-CoA | |
| Produkte | Acetyl-CoA + Acetoacetat | |
| Vorkommen | ||
| Homologie-Familie | HMGCL-like | |
| Übergeordnetes Taxon | Lebewesen | |
Hydroxymethylglutaryl-CoA-Lyase (kurz: HMG-CoA-Lyase oder HL) ist das Enzym, das die Spaltung von HMG-CoA in Acetyl-CoA und Acetoacetat katalysiert. Diese Reaktion ist in Pflanzen und Bakterien Teil des Mevalonatwegs zum Aufbau der Isoprenoide, und in den Mitochondrien und Peroxisomen der Wirbeltiere Teil der Synthese der Ketokörper und des Abbaus der Aminosäure Leucin. Beim Mensch ist das Enzym in Fibroblasten, Lymphozyten und der Leber lokalisiert. Mutationen im HMGCL-Gen können zum erblichen Enzymmangel führen, der mit schwerer Hypoglykämie und Koma einhergeht. HL-Mangel ist außerhalb Saudi-Arabiens, Portugals und Japans extrem selten.[1][2][3][4]
Katalysierte Reaktion
HMG-CoA ⇒ Acetyl-CoA + Acetoacetat
HMG-CoA wird zu Acetyl-CoA und Acetoacetat umgesetzt.
Einzelnachweise
- ↑ UniProt P35914
- ↑ Muroi J, Yorifuji T, Uematsu A, et al: Molecular and clinical analysis of Japanese patients with 3-hydroxy-3-methylglutaryl CoA lyase (HL) deficiency. In: Hum. Genet. 107. Jahrgang, Nr. 4, Oktober 2000, S. 320–6, PMID 11129331 (springer.de).
- ↑ Mitchell GA, Ozand PT, Robert MF, et al: HMG CoA lyase deficiency: identification of five causal point mutations in codons 41 and 42, including a frequent Saudi Arabian mutation, R41Q. In: Am. J. Hum. Genet. 62. Jahrgang, Nr. 2, Februar 1998, S. 295–300, doi:10.1086/301730, PMID 9463337, PMC 1376904 (freier Volltext).
- ↑ Ashmarina LI, Rusnak N, Miziorko HM, Mitchell GA: 3-Hydroxy-3-methylglutaryl-CoA lyase is present in mouse and human liver peroxisomes. In: J. Biol. Chem. 269. Jahrgang, Nr. 50, Dezember 1994, S. 31929–32, PMID 7527399 (jbc.org).
Weblinks
- Gopinathrao/reactome.org: HMG CoA ⇒ acetoacetic acid+ acetyl CoA