QPNC-PAGE
- Seiten mit defekten Dateilinks
- Elektrophorese
- Abkürzung
QPNC-PAGE (Abkürzung für engl.: quantitative preparative native continuous polyacrylamide gel electrophoresis) ist eine standardisierte Variante der Elektrophorese, speziell der Gelelektrophorese. Diese analytische Methode der Biochemie und Bioanorganischen Chemie dient zur Trennung von geladenen Molekülen in einem homogenen elektrischen Feld und gestattet die quantitative Abtrennung und Isolierung von Metalloproteinen aus menschlichen, pflanzlichen oder tierischen Proben mit hoher Auflösung. Proteine werden entsprechend den isoelelektrischen Punkten aufgetrennt und mit Hilfe der NMR-Spektroskopie analysiert. Die Methode leistet dadurch einen wichtigen Beitrag zur Strukturaufklärung von nativen und denaturierten Metalloproteinen sowie Proteinisomeren und deren Interaktionen in komplexen Proteingemischen.
Elektrophorese-Apparatur
Die Trennung der Proteine erfolgt in einer handelsüblichen Elektrophoresekammer für präparative PAGE. Sie ist aufgebaut aus verschiedenen Komponenten, der oberen und unteren Elektrophoresekammer sowie der Gelsäule mit Elutionskammer und Kühlfinger (siehe Abbildung „Elektrophoresezelle“). Als Zusatzgeräte zur Elektrophoresekammer dienen eine Gleichspannungsquelle, eine peristaltische Pumpe für den Transport des Eluenten zu einem Fraktionssammler, ein UV-Detektor mit Rekorder und eine Rezirkulationspumpe für den unteren Elektrophoresepuffer zur Kühlung des Gels. Alle Geräte, außer Spannungsquelle und Rekorder, werden während der Elektrophorese in einem Kühlschrank konstant bei 4 °C gekühlt.
Elektrophoresepuffer und Gel
Als kontinuierlicher Elektrophoresepuffer wird bei QPNC-PAGE eine spezielle Pufferlösung, eine Mischung aus 20 mM Tris-HCl und 1 mM NaN3, mit dem pH-Wert 10,00 gewählt. Kontinuierlich bedeutet in diesem Zusammenhang, dass sowohl der Anodenpuffer, als auch der Kathodenpuffer sowie der Puffer zur Herstellung des Polyacrylamid-Gels die gleiche chemische Zusammensetzung und Konzentration haben. Die meisten Proteine eines lebenden Organismus sind bei dem pH-Wert von 10,00 negativ geladen und wandern im elektrischen Feld daher von der Kathode zur Anode (siehe Abbildung „Elektrophoresezelle“). Der Stromfluss zwischen Kathode und Anode wird durch Elektrodenreaktionen in Form der Elektrolyse von Wasser erzeugt. An der Kathode entsteht dabei gasförmiger Wasserstoff und an der Anode Sauerstoff im Verhältnis 2:1. Diese elektrochemischen Reaktionen verdeutlichen, dass das verwendete Puffersystem eine hohe Kapazität besitzt. Die bei der Elektrophorese im Gel entstehende Wärme wird einerseits durch Kühlung von außen, und andererseits durch einen inneren Kühlkreislauf in der Elektrophoresekammer abgeführt (siehe Abbildung „Elektrophoresezelle“).
Das Polyacrylamid-Gel muss auf Grund der technischen Vorgaben der verwendeten Elektrophoresekammer vor jedem Lauf frisch hergestellt werden (siehe Abbildung „Elektrophoresezelle“). Die Herstellung erfolgt prinzipiell so wie es in dem Artikel Polyacrylamid-Gelelektrophorese beschrieben ist, jedoch wird bei QPNC-PAGE ein Trenngel ohne Sammelgel verwendet. Das fertige Gel verfügt über eine großporige Struktur mit einem Gesamtmonomeranteil von 4 % T (T = Gesamtanteil von Acrylamid und N,N-Methylenbisacrylamid im Gel [w/v]) mit einer Quervernetzung von 2,67 % C (C = Verhältnis N,N-Methylenbisacrylamid/Acrylamid [w/w]). Es verfügt über eine Höhe von 40 mm mit einem inneren Durchmesser von 28 mm (siehe Abbildung „Elektrophoresezelle“). Als Katalysator für die Polymerisierung werden 0,5 µL TEMED/ml Gel eingesetzt, der Anteil an APS als Radikalstarter bezogen auf den Gesamtmonomerengehalt des Gels beträgt 1,25 % [w/w].
Das Gel wird außerhalb der Elektrophoresekammer auf einer speziellen Vorrichtung, auf der die Gelsäule und der Kühlfinger befestigt sind, gegossen. Es benötigt insgesamt 69 Stunden zur vollständigen Polymerisation bei Raumtemperatur, wobei es sich um eine exotherme Reaktion handelt. Die dabei entstehende Wärme wird mit Hilfe des inneren Kühlkreislaufs der Elektrophoresekammer abgeführt (siehe Abbildung „Elektrophoresezelle“). Dieses Vorgehen bewirkt, dass sich keine freien Monomere mehr im Gel befinden, wodurch Reaktionen von Gelkomponenten (Gelmatrix) mit den zu isolierenden Analyten (Proteine) ausgeschlossen werden können. Molekularsiebeffekte oder sonstige Interaktionen der Gelmatrix mit den Analyten (siehe Gelelektrophorese) können auf Grund der Porengröße und Homogenität des Gels als vernachlässigbar gering eingestuft werden. Das Gel ist mechanisch stabil und lässt sich gut handhaben. Die Polymerisationsdauer des Gels verbunden mit der Komprimierung der Gelporen hat entscheidende Bedeutung für die Reproduzierbarkeit der Elutionszeiten von Metalloproteinen im Elektropherogramm (siehe Abbildung „Elektropherogramm“).
Zu analysierende Proben werden vor der Elektrophorese mit 10 % [v/v] Glycerin vermischt, um eine Denaturierung der Inhaltsstoffe bei der Probenaufgabe zu vermeiden. Die Probe selbst, deren Gesamtproteingehalt nicht mehr als 0,5 mg betragen soll, erhält dadurch eine höhere Dichte und lässt sich kontrolliert unter den Kathodenpuffer auf die Geloberfläche applizieren (siehe Abbildung „Elektrophoresezelle“).
Trennprinzip und Quantifizierung
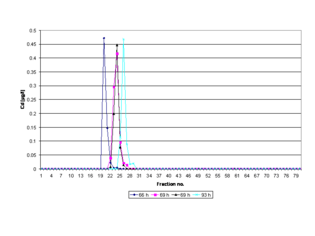
Die Aufreinigung biologischer Proben (z.B. Blut, Nervenwasser) und Isolierung von Metalloproteinen aus diesen komplexen Gemischen ist besonders effektiv, weil die Fraktion der ungeladenen polaren Moleküle (z.B. Zucker) und der positiv geladenen Molekülionen (Kationen) nicht durch das Gel migriert, sondern im Kathodenpuffer (siehe Abbildung „Elektrophoresezelle“) gelöst zurückbleibt. Die in der Probe vorliegenden negativ geladenen Molekülionen (Anionen) wandern durch das Gel in Richtung Anode und werden in der Elutionskammer kontinuierlich eluiert (siehe Abbildung „Elektrophoresezelle“). Bei diesem Vorgang werden zuerst die kleinen anorganischen und organischen Anionen eluiert und danach die Proteine in Fraktionen isoliert (siehe Abbildung „Elektropherogramm“). Folglich wird die Probenmatrix vollständig von den Analyten abgetrennt.
Die Eigenschaften der QPNC-PAGE bewirken ferner, dass bei einem elektrophoretischen Lauf weder die Größen (Molekülmassen) noch die Formen (Gestalt) der zu isolierenden Proteine eine Trennung beeinflussen. Stattdessen erfolgt die Isolierung der aufgetrennten Proteine (Metalloproteine, Proteine mit organischen Cofaktoren und ohne Cofaktoren) und Peptide ausschließlich entsprechend den isoelektrischen Punkten (pI). Native und denaturierte Moleküle eines Proteins haben jeweils unterschiedliche isoelektrische Punkte, wobei die Geschwindigkeit der Migration eines Proteins durch das Gel direkt vom jeweiligen pI abhängig ist. Proteinisomere sowie native und denaturierte Metalloproteine, die beispielsweise nebeneinander in einer Probe vorliegen, werden daher hoch aufgelöst in einem Elektropherogramm dargestellt.
Die aufgetrennten Moleküle wandern jeweils mit unterschiedlich konstanter Geschwindigkeit als ringförmige Proteinbanden durch das Gel (siehe Abbildung „Elektrophoresezelle“) und werden dann von einem physiologischen Puffer (20 mM Tris-HCl, 1 mM NaN3, pH 8,00) reproduzierbar eluiert und in Fraktionen isoliert (siehe Abbildung „Elektropherogramm“). Bei einer Trennung werden weder die vorliegenden Metall-Proteinkomplexe dissoziiert, noch die nativen Konformationen verändert. Das Auflösungsvermögen der QPNC-PAGE für Metallcofaktoren (z. B. Fe, Cu, Zn, Ni, Mo, Pd, Co, Mn, Pt, Cr oder Cd) bewegt sich im physiologisch wirksamen Bereich von ungefähr 1 ng/ml. Nach einer Identifizierung und absoluten Quantifizierung der Metallcofaktoren mit der ICP-MS (Abkürzung für engl.: inductively coupled plasma mass spectrometry) kann ein isoliertes Metallprotein aufgrund seiner hohen Reinheit und optimierten Konzentration der NMR-Spektroskopie quantitativ zugeführt werden.
Einsatzgebiete

Mit Hilfe der NMR-Spektroskopie können ein- oder mehrdimensionale Proteinstrukturen in bestimmten PAGE-Fraktionen von nativen und fehlgefalteten Proteinen aufgeklärt und mit Hilfe der Bioinformatik Struktur-Funktionsbeziehungen für verschiedene Metalloproteine (z. B. Metallochaperone, Prionen, Metalloenzyme, Metallopeptide (z.B. Beta-Amyloid u. a.)) ermittelt werden. Proteine und deren Interaktionen können dabei präzise analysiert werden. Besonders wichtig ist dieser Ansatz für die klinische Diagnostik und Therapie im Bereich von Krankheiten, deren Ursachen in einer Fehlfaltung der Proteine liegen, wozu beispielsweise Alzheimersche Krankheit, Creutzfeldt-Jakob-Krankheit und verschiedene Krebserkrankungen zählen. Besondere Bedeutung für die Entwicklung neuer Medikamente für bestimmte Proteinfehlfaltungserkrankungen haben mittlerweile Heilpflanzen und Nutzpflanzen erlangt. Im industriellen Maßstab werden zu diesem Zweck pharmakologisch wirksame rekombinante Proteine (siehe Molecular Pharming) oder andere biologisch aktive Pflanzeninhaltsstoffe erzeugt, deren Wirkung im Organismus (engl.: „relative biochemical impact“) mit Hilfe einer Strategie bestehend aus analytischen, biochemischen und biophysikalischen Verfahren nachgewiesen werden kann. Die interdisziplinäre Ausrichtung der verwendeten Methodik soll verhindern, dass es sich bei den entsprechenden Ergebnissen um Artefakte handelt.
Literatur
- N. Fitri, B. Kastenholz, B. Buchari, M.B. Amran, F.M. Warganegara: Molybdenum speciation in raw phloem sap of castor bean. In: Anal. Lett. 41, 2008, S. 1773–1784.
- B. Kastenholz, D.E. Garfin: Medicinal plants: a natural chaperones source for treating neurological disorders. In: Protein Pept. Lett. 16, 2009, S. 116-120.
- B. Kastenholz: Important contributions of a new quantitative preparative native continuous polyacrylamide gel electrophoresis (QPNC-PAGE) procedure for elucidating metal cofactor metabolisms in protein-misfolding diseases – a theory. In: Protein Pept. Lett. 13, 2006, S. 503-508.