Wie stellen Pflanzen scharfe Substanzen her?
Bio-News vom 27.01.2023
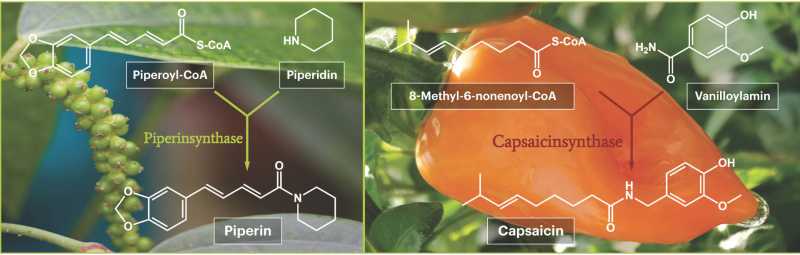
Wissenschaftlerinnen und Wissenschaftler haben das entscheidende Enzym gefunden, das den Früchten der Pfefferpflanze (lat Piper nigrum) zu ihrer charakteristischen Schärfe verhilft.
Das entdeckte Enzym, die Piperinsynthase, katalysiert den finalen Schritt der Biosynthese des scharfschmeckenden Piperins. Nun haben die Biochemiker mit einem zweiten Scharfstoff nachgelegt und auch die Biosynthese von Capsaicin aus der Chilischote (Capsicum spec.) näher beleuchtet. Erstmals beschreibt seine Arbeitsgruppe die enzymatische Aktivität der lange gesuchten Capsaicinsynthase. Das Enzym katalysiert den letzten Reaktionsschritt der pflanzlichen Capsaicinproduktion.
Publikation:
Raika Milde, Arianne Schnabel, Toni Ditfe, Wolfgang Hoehenwarter, Carsten Proksch, Bernhard Westermann & Thomas Vogt
Chemical Synthesis of Trans 8-Methyl-6-Nonenoyl-CoA and Functional Expression Unravel Capsaicin Synthase Activity Encoded by the Pun1 Locus
Molecules 27 (20), 6878 (2022)
DOI: 10.3390/molecules27206878
Publikation:
Schnabel, A., Athmer, B., Manke, K. et al.
Identification and characterization of piperine synthase from black pepper, Piper nigrum L.
Commun Biol 4, 445 (2021)
Piperin und Capsaicin binden auf Zunge und Schleimhäuten an genau den Rezeptor, der auch auf Hitze, Säuren oder Verletzung reagiert. Dieser Rezeptor löst in bestimmten Nervenzellen einen Reiz aus, den der Mensch als Schärfe empfindet. Capsaicin und Piperin wirken zudem antimikrobiell sowie verdauungs- und durchblutungsfördernd. Sie sind daher nicht nur als Scharfmacher interessant, sondern auch als Wirkstoffe für medizinische Anwendungen. „Man findet in der Literatur der letzten Jahre hunderte Studien zur biologischen Wirkung von Pfeffer- und Chili-Extrakten, aber nur sehr wenige zur Biosynthese der scharfen Substanzen“, erklärt Thomas Vogt, der am IPB die Arbeitsgruppe Phenylpropanstoffwechsel leitet.
Das mag daran liegen, dass die Aufklärung von pflanzlichen Biosynthesewegen verschiedener Expertisen bedarf, die in dieser Kombination nur an wenigen Forschungsinstituten vorhanden sind. Idealerweise ziehen Chemiker, Biochemiker und Bioinformatiker an einem Strang, um aus den hunderten Enzymen einer Pflanze jene Handvoll Kandidaten zu fischen, die an der Produktion eines gesuchten Stoffes beteiligt sind. Diese Suche nach einzelnen Enzymen ist vor allem bei jenen Pflanzenarten schwierig, von denen die meisten Gene und Enzyme noch unbekannt sind. „Denn hier“, sagt Thomas Vogt, „kann man die Datenbanken nur begrenzt zu Rate ziehen.“
Biosynthesen und Enzyme

© mazzachi / Depositphotos
Enzyme sind Proteine, die in jedem Lebewesen und in jeder Zelle vorkommen. Jede Reaktion im Körper, bei der ein Stoff in einen anderen Stoff umgewandelt wird (Stoffwechsel), wird von einem Enzym katalysiert.
Es gibt in jedem Organismus tausende Reaktionen des Stoffwechsels und entsprechend genauso viele verschiedene Enzyme. Dabei bilden mehrere hintereinander verlaufende Einzelreaktionen separate Stoffwechsel- oder Biosynthesewege, die zu vielen verschiedenen Endprodukten führen.
In der Fähigkeit, ein breites Spektrum an komplexen Stoffen zu produzieren, sind Pflanzen den Tieren überlegen. Deshalb verfügen sie auch über sehr viel mehr Enzyme als tierische Organismen. Der Mensch nutzt Enzyme seit Jahrtausenden, beispielsweise zur Herstellung von Brot, Sauerkraut, Alkohol und Käse.
Auch beim Pfeffer war die Datenlage dünn und es gab weitere Hürden. So mussten die Hallenser Wissenschaftler zunächst Pfefferpflanzen heranziehen und vor allem dafür sorgen, dass sie Früchte tragen. „Das ist bei Pfeffer, der im Gewächshaus wächst, nicht selbstverständlich“, erklärt der Biochemiker, „aber den Gärtnern am Institut ist es gelungen.“ Mit erfolgreicher Anzucht der Pflanzen konnte das Forscherteam in einem Zeitraum von drei Monaten Pfefferbeeren in verschiedenen Reifestadien ernten und hier genau beobachten, wie deren Piperingehalt stetig ansteigt. In den reifenden Beeren, so die These der Wissenschaftler, sollten demnach auch die Enzyme zu finden sein, die das Piperin bilden. Die Blätter der Pflanze hingegen dürften die Piperinbiosynthese-Enzyme nicht enthalten, denn sie produzierten kein Piperin und schmecken daher auch nicht scharf.
Diese Differenzen im Piperingehalt, also im Vorhanden- und Nichtvorhandensein der Piperinbiosynthese-Enzyme machten sich die Wissenschaftler zunutze. Unter der Prämisse, dass ein Enzym in bestimmten Geweben nur dann vorhanden ist, wenn sein Gen aktiviert ist und abgelesen wird, verglichen sie die Genaktivitäten in Blättern und Früchten verschiedener Reifegrade miteinander. So konnten sie jene Gene identifizieren, die in den unreifen Früchten besonders aktiv sind. Unter ihnen auch das Gen für die Piperinsynthase. Dieses Gen wurde anschließend in Mikroorganismen eingeschleust und diente den Bakterien als Vorlage für die Produktion des Piperinsynthase-Enzyms. Für das isolierte Enzym konnten die Hallenser Pfeffer-Experten dann zweifelsfrei nachweisen: es katalysiert den Zusammenschluss der beiden Ausgangsstoffe Piperoyl-CoA und Piperidin zum Piperin. Der Beweis, dass es sich hier tatsächlich um die gesuchte Piperinsynthase handelt, war damit erbracht.
Bei der Entdeckung der Capsaicinsynthase gab es andere Probleme. Hier war das codierende Gen bereits identifiziert, doch ist es der Wissenschaft nie zuvor gelungen, daraus ein enzymatisch aktives Protein in Bakterien herstellen zu lassen. Der Beweis, dass es sich bei dem untersuchten Gen überhaupt um die Capsaicinsynthase handelte, stand daher noch aus. Aber mit ihrem Fachwissen vom relativ ähnlichen Pfefferenzym konnten die Hallenser Pflanzenforscher die Capsaicinsynthase isolieren und im finalen Aktivitätstest beweisen, dass sie tatsächlich die seit langem postulierte Reaktion der beiden Ausgangsstoffe, 8-Methyl-6-nonenoyl-CoA und Vanilloylamin zum Capsaicin katalysiert. Diese finalen Aktivitätsnachweise für Piperin- und Capsaicinsynthase gelangen unter anderem auch deshalb, weil die Synthesechemiker des Instituts alle Ausgangsstoffe, die es noch nicht zu kaufen gibt, selbst herstellen und für die Enzymtests zur Verfügung stellen konnten.
Die wichtigsten Reaktionsschritte der Piperinbiosynthese und der Capsaicinbiosynthese sind damit aufgeklärt. Irgendwann wird man beide Biosynthesewege vollständig verstanden haben. Doch was bringt die Erkenntnis für einen Gewinn? Mit dem Wissen um alle beteiligten Enzyme einer Biosynthese kann man die entsprechenden Gene in Mikroorganismen bringen und diese den gewünschten Wirkstoff produzieren lassen. „Bei Pfeffer wäre das allerdings nicht wirtschaftlich“, sagt Thomas Vogt, „denn Piperin ist in den Pfefferbeeren in so hoher Konzentration vorhanden, dass es, beispielsweise für medizinische Zwecke, sehr einfach isoliert werden könnte.“
Für die Wissenschaftler am IPB ist die Aufklärung von Biosynthesewegen dennoch lohnenswert, denn die neu entdeckten Enzyme katalysieren interessante Reaktionen, die zu Reaktionsprodukten mit komplizierten Strukturen führen. Diese Enzyme können von den Biochemikern modifiziert werden, sodass völlig neue Enzyme mit gewünschten Eigenschaften entstehen. Die optimierten Enzyme nutzt man dann, um im Reagenzglas Synthesen von neuen, potentiell wirksamen Substanzen zu designen. Diese Art der biokatalytischen Synthese – das heißt die Nachahmung und Optimierung der ursprünglichen pflanzlichen Biosynthese im Reagenzglas – hat als relativ junges Forschungsfeld enormes Zukunftspotential. Als Alternative zu petrolchemischen Synthesen kann die Biokatalyse gewünschte Substanzen ohne den Einsatz von giftigen Katalysatoren und Lösungsmitteln oder die Entstehung von schädlichen Nebenprodukten erzeugen.
Diese Newsmeldung wurde mit Material des Instituts für Pflanzenbiochemie via Informationsdienst Wissenschaft erstellt.