Peptidoglycane
Peptidoglycane (PGN), Peptidoglykane, auch Murein (aus dem Latein murus = Mauer, Wall, Schutz[1]), seltener Polysaccharid-Peptide genannt, sind aus Zuckern und Aminosäuren zusammengesetzte Makromoleküle, die in der Zellwand von Bakterien (Murein-Sacculus) vorkommen. Sowohl grampositive als auch gramnegative Bakterien besitzen in ihrer Zellwand eine Festigkeit verleihende Schicht aus einem Peptidoglycan. Die Dicke der Hülle ist unterschiedlich, bei grampositiven 20 bis 80 nm, bei gramnegativen weniger als 10 nm. Ausnahmen bilden die zur Domäne der Bakterien zählenden Mycoplasmen und Spiroplasmen, die keine Zellwand und damit auch keine Mureinhülle besitzen, sowie die Planctomyceten[2], die eine proteinreiche S-Layer-Zellwand aufweisen.
Aufbau
Peptidoglycane bestehen aus Strängen der zwei β(1→4) glycosidisch miteinander verknüpften Zuckerderivatmoleküle N-Acetylglucosamin und N-Acetylmuraminsäure (siehe Bild 1), die als lineare Kettenmoleküle das Rückgrat bilden. Von jedem N-Acetylmuraminsäure-Molekül geht – an dessen Lactylgruppe gebunden – eine Oligopeptidkette zu einem N-Acetylmuraminsäure-Molekül eines benachbarten Stranges (siehe Bild 2). Die Zusammensetzung bei grampositiven wie auch gramnegativen Bakterien ist nicht immer einheitlich. So besitzen die meisten grampositiven Kokken statt Diaminopimelinsäure (DAP) L-Lysin. Manchmal ist die Aminosäure an Position 2 noch zusätzlich hydroxyliert.[3] Ein wichtiges Charakteristikum des Tetrapeptides ist das Vorhandensein von D-Aminosäuren wie D-Alanin bzw. D-Glutaminsäure, die enzymatisch durch Racemasen aus den entsprechenden L-Aminosäuren gebildet werden.
Vernetzung
Die parallel angeordneten Stränge sind quervernetzt. Für diese Verbindung wird ein Enzym benötigt welches als Transpeptidase die Peptidketten miteinander verknüpfen kann. Diese Transpeptidase wird auch als Penicillin-bindendes-Protein (PBP) bezeichnet da sie der Angriffspunkt der Beta-Lactam-Antibiotika ist. Sie kann unterschiedlich aufgebaut und deshalb resistent gegen diese Antibiotika sein.
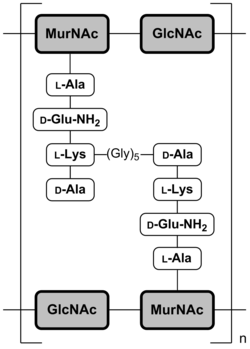
Bei Escherichia coli und anderen gram-negativen Bakterien sind die beiden Tetrapeptide direkt verbunden (Abb. 2a). Hierbei ist die Aminogruppe der Diaminopimelinsäure des einen Peptids an die Carboxygruppe des terminalen D-Alanins des benachbarten Peptids verknüpft.
Bei Staphylococcus aureus bzw. gram-positiven Bakterien verbindet eine Interpeptidbrücke aus fünf Glycinmolekülen (syn. Pentaglycinbrücke, Pentapeptidbrücke[4]) zwei Tetrapeptide (Abb. 2b).
Da das Verbindungsstück von Organismus zu Organismus verschiedene Aminosäuren enthalten kann, trägt dies dazu bei, dass über 100 unterschiedliche Arten von Peptidoglycanen bekannt sind.[3] Die Varianz der Aminosäuresequenz ist bei Grampositiven Bakterien stärker als bei Gramnegativen. Lediglich Histidin, Arginin oder Prolin wurden noch nicht in einem Verbindungsstück nachgewiesen.
Durch die Quervernetzung bildet das Murein ein flächiges Netz, das die Oberfläche der Bakterienzelle umspannt (Murein-Sacculus, siehe Abb. 3). In allen Fällen ist das Zuckerrückgrat gleich aufgebaut.
Abb. 2a: Schematische Darstellung der Mureinschicht von Escherichia coli[3]
MurNAc = N-Acetylmuraminsäure;
GlcNAc = N-Acetylglucosamin;
DAP = DiaminopimelinsäureAbb. 2b: Schematische Darstellung der Mureinschicht von Staphylococcus aureus[3]
MurNAc = N-Acetylmuraminsäure;
GlcNAc = N-Acetylglucosamin
Grampositive und gramnegative Bakterien
Ein Bakterium ist von einem einzigen Murein-Makromolekül umgeben. Gramnegative Bakterien (in der Gram-Färbung sich negativ verhaltend) besitzen eine dünne, einschichtige Mureinhülle, die etwa 5-10 % der Trockenmasse der Bakterienhülle ausmacht. Bei grampositiven Bakterien ist die dickere Zellwand aus einem mehrschichtigen Mureinnetz und Teichonsäuren aufgebaut. Der Mureinanteil kann hier bis zu 50 % der Trockenmasse der Bakterienhülle betragen, die durch basische Farbstoffe Gram-Färbung annimmt.[5]
Funktion, Erweiterung und Bedeutung
Die Mureinhülle hält den Bakterienprotoplasten gegen den osmotischen Innendruck zusammen. Wird die Mureinschicht verletzt oder aufgelöst, zum Beispiel durch das Enzym Lysozym, platzt das Bakterium. Beim Wachstum eines Bakteriums muss deshalb das Mureinnetz erweitert werden, ohne dass eine größere Lücke entsteht. Mureinbausteine werden im Cytoplasma synthetisiert und mit Hilfe des Lipidcarriers Bactoprenol (siehe auch: Transporter (Membranprotein)) exportiert. In dem außerhalb der Cytoplasmamembran gelegenen Mureinnetz werden durch spezifische lytische Enzyme lokal begrenzt Bindungen in den Rückgratsträngen und in den Oligopeptiden gelöst und die vorgefertigten und exportierten Mureinbausteine werden durch spezifische Enzyme eingefügt. Die Erweiterung des Mureins erfordert also ein genaues Zusammenspiel verschiedener Enzyme. Wird dieses Zusammenspiel gestört, platzt das Bakterium ebenfalls. Einige der wichtigsten Antibiotika, wie z. B. Vancomycin und Penicillin hemmen den Aufbau der Peptidoglycanschicht.
Siehe auch
Einzelnachweise
- ↑ Murus bei Lateinwiki.de Abgerufen am 2. November 2009
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Planctomycetales im Lexikon der Biologie, http://www.wissenschaft-online.de/biologie, abgerufen am 15. Februar 2012.
- ↑ 3,0 3,1 3,2 3,3 Michael T. Madigan und John M. Martinko: Brock Mikrobiologie. Pearson Studium; 11. aktualisierte Auflage 2009; ISBN 978-3-8273-7358-8; S. 83f.
- ↑ K. Aktories, U. Förstermann, F. Hofmann und K. Starke: Allgemeine und spezielle Pharmakologie und Toxikologie. 10. Auflage. München, Elsevier 2009. ISBN 978-3-437-42522-6
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Murein im Lexikon der Biologie, abgerufen am 22. November 2008.