Lyme-Borreliose
- Seiten mit Skriptfehlern
- Wikipedia:Vorlagenfehler/Vorlage:Webarchiv/Archiv-URL/Alle
- Wikipedia:Vorlagenfehler/Vorlage:Webarchiv/Archiv-URL/web.archive.org
- Wikipedia:Vorlagenfehler/Vorlage:Cite journal/temporär
- Wikipedia:Vorlagenfehler/Vorlage:Literatur/Parameterfehler
- Wikipedia:Belege fehlen
- Zoonose
- Hautkrankheit
- Entzündliche Krankheit des Zentralnervensystems
- Krankheitsbild in der Inneren Medizin
- Borreliose
- Berufskrankheit
- Bakterielle Infektionskrankheit bei Hunden
- Pferdekrankheit
- Bakterielle Infektionskrankheit bei Tieren
| Klassifikation nach ICD-10 | |
|---|---|
| A69.2 | Lyme-Krankheit Erythema chronicum migrans durch Borrelia burgdorferi |
| ICD-10 online (WHO-Version 2019) | |
Die Lyme-Borreliose oder Lyme-Krankheit ist eine multisystemische Infektionskrankheit, die durch das Bakterium Borrelia burgdorferi oder verwandte Arten aus der Gruppe der Spirochäten ausgelöst wird. Die Krankheit kann jedes Organ befallen, speziell das Nervensystem und die Gelenke. Die Erkrankung kommt beim Menschen und bei allen Säugetieren sowie Vögeln vor. Die Übertragung erfolgt vor allem durch den Holzbock (Ixodes ricinus), eine Zeckenart; sehr selten auch durch Stechmücken oder Pferdebremsen.[1]
Entdeckung und Namensgebung
Die Bezeichnung Lyme-Borreliose setzt sich zusammen aus den Namen der Orte Lyme und Old Lyme im US-Bundesstaat Connecticut, in denen das Krankheitsbild 1975 nach gehäuftem Auftreten von Gelenksentzündungen in Verbindung mit Zeckenstichen erstmals beschrieben wurde, sowie aus der Bezeichnung der Erregerfamilie, die nach dem französischen Bakteriologen Amédée Borrel benannt ist. Dem Arzt und Bakteriologen Willy Burgdorfer gelang 1981 erstmals der Nachweis eines Erregers aus Zecken und 1982 seine Anzucht. Ihm zu Ehren wurde dieser Keim Borrelia burgdorferi benannt.
Erreger
Borrelien sind gramnegative spiralförmige Bakterien und gehören zur Familie der Spirochäten. Erreger der Lyme-Borreliose sind die Arten Borrelia burgdorferi sensu stricto, B. garinii, B. afzelii und B. spielmanii. Neben diesen dem Borrelia-burgdorferi-Komplex zugeordneten Arten existieren noch weitere humanpathogene Borrelienarten; B. recurrentis und B. hermsii, die Erreger des Rückfallfiebers.
In den USA ist Borrelia burgdorferi sensu stricto als humanpathogene Art verbreitet; in Deutschland sind die anderen Arten verbreiteter, was als Ursache unterschiedlicher Manifestationen in Europa und Amerika diskutiert wird.
Statistik
Verbreitung
Der Erreger der Lyme-Borreliose ist weltweit verbreitet. In Deutschland gibt es ein Süd-Nordgefälle bei der Durchseuchung des Holzbocks. Während in den nördlichen Bundesländern die Zeckenpopulation nur zu etwa 6 bis 10 Prozent mit Borrelien durchseucht sein soll, liegt die Durchseuchungsrate im süd- und mitteldeutschen Raum deutlich höher. Regional kann auch jede zweite Zecke Borrelienüberträger sein. Jedoch fehlen aktuelle und ausreichend flächendeckende Studien für Deutschland.
Es fehlen flächendeckende epidemiologische Studien und Daten über die Ausbreitung und das Infektionsrisiko nicht nur der einzelnen Genospezies für den Menschen. Ebenso sind die Pathomechanismen, der Verlauf der einzelnen Krankheitsmanifestationen und deren Behandelbarkeit noch unzureichend erforscht. Im Gegensatz zur artverwandten Syphilis, der durch Läuse übertragenen Borrelia recurrentis sowie der ebenfalls durch Zecken übertragenen FSME wurde die Borreliose nicht in das Infektionsschutzgesetz aufgenommen. In den neuen Bundesländern und Berlin besteht jedoch eine auf landesrechtlicher Ebene geregelte Meldepflicht für die Erkrankung Lyme-Borreliose. Hier werden die Falldefinitionen des Robert-Koch-Instituts zugrunde gelegt, die jedoch lediglich eine Meldung des Erythema chronicum migrans, der frühen Neuroborreliose und der Lyme-Arthritis vorsehen. Das Erythema migrans tritt jedoch nur in etwa 50 % der Neuerkrankungen auf.
Bei der DNA-Sequenzierung der 5300 Jahre alten Gletschermumie Ötzi wurden Spuren von Borrelia burgdorferi gefunden.[2] Damit ist dies der älteste dokumentierte Borreliose-Fall in der Menschheitsgeschichte und der erste Nachweis in einem nicht mehr lebenden Individuum überhaupt.[3]
Infektionsrisiko und Durchseuchungsraten
Lyme-Borreliose ist in der nördlichen Hemisphäre die häufigste von Zecken übertragene Erkrankung.[4] Eine Borrelieninfektion durch Zecken ist – im Gegensatz zu der durch Viren hervorgerufenen FSME – in ganz Deutschland und sogar in Städten möglich. Wie eine Studie des Robert-Koch-Instituts in Zusammenarbeit mit dem dem Nationalen Referenzzentrum für Borrelien am Max-von-Pettenkofer-Institut für Hygiene und Mikrobiologie in München zeigte, stellt „der direkte Kontakt mit Büschen in Gärten, insbesondere in Waldnähe, ein bisher unterschätztes Risiko dar, über Zeckenstiche an [...] Lyme-Borreliose zu erkranken“.[5] Gleichwohl hat nicht jeder Zeckenstich eine Borrelieninfektion oder gar eine Erkrankung an Borreliose zur Folge. Nach Schätzung des Robert-Koch-Instituts liegt die Wahrscheinlichkeit, nach einer in Deutschland erlittenen Zeckenattacke an Borreliose zu erkranken, bei 1 zu 300.
Die Durchseuchungsraten der Zecken mit Borrelien variieren je nach Region und reichen von ca. 5 bis weit über 40 Prozent. Im Mittel liegt die Befallsrate in Deutschland bei etwa 20 Prozent. Forscher gehen in Hochrisikogebieten, wie z. B. in Teilen von Süddeutschland, von 30 bis 50 Prozent borrelienbefallener Zecken aus. In der Region Konstanz am Bodensee lag die mittlere Durchseuchungsrate der Zecken mit Borrelien (B. burgdorferi Spezies) bei 35 Prozent.[6] Im Englischen Garten und den Isar-Auen in München waren über 30 % der gefundenen Zecken von Borrelien befallen.[7]
In Deutschland kamen die meisten kassenärztlich abgerechneten Borrelien-Behandlungsfälle in Brandenburg, Sachsen und Bayern entlang der Grenze zu Polen und Tschechien vor, weitere Schwerpunkte waren Franken und Teile der Pfalz.[8] Eine gesetzliche Meldepflicht für Borreliose besteht nur in Berlin und den neuen Bundesländern. Dort werden pro Jahr über 5000 Neuerkrankungen an das Robert-Koch-Institut gemeldet. Rund 70 Prozent aller gemeldeten Fälle traten in den Monaten Juni bis September auf.[9] Dies entsprach einer Inzidenz (Zahl der in einer Bevölkerung neu auftretender Erkrankungen pro Jahr) von über 30 Fällen pro 100.000 Einwohner, wobei einzelne Landkreise Inzidenzen über 150 aufwiesen (zum Vergleich: übersteigt in einem Landkreis die Inzidenz für FSME im 5-Jahres-Schnitt den Wert von 1,0 pro 100.000 Einwohner, so wird er vom RKI als FSME-Risikogebiet definiert[10]).
Für Österreich werden Inzidenzen zwischen 135[11] und 300[12] pro 100.000 Einwohner angegeben, für die Schweiz zwischen 25[13] und 30,4[14].
An der Universität Heidelberg wurde in einer Studie das Infektionsrisiko nach einem Zeckenstich ermittelt: Hiernach infizierten sich im Durchschnitt 3,3 Prozent aller von Zecken gestochenen Personen. Betrachtet man jedoch nur die mit Borrelia burgdorferi befallenen Zecken, so liegt die Gefahr, sich zu infizieren, bei 25,6 Prozent. Die Durchseuchungsrate der Zecken betrug dabei 11 Prozent.[15] Bei einer höheren Durchseuchungsrate ist demzufolge auch von einem höheren Infektionsrisiko nach einem Zeckenstich auszugehen.
In einem 1998 von führenden Borrelioseforschern in Deutschland publizierten Konsensuspapier findet man folgende Angaben zur Erkrankungswahrscheinlichkeit nach einem Zeckenstich (Angaben für Gesamtdeutschland, unabhängig davon ob die Zecken infiziert waren oder nicht):
- eine Serokonversion, also das Ansprechen des Immunsystems auf den Erreger nach Infektion, ist bei 2,6–5,6 % der Betroffenen zu erwarten
- eine manifeste Erkrankung jedoch nur bei 0,3–1,4 %.
Zuverlässige Zahlen hierzu gibt es nicht. Legt man aber diese Zahlen zugrunde, kann man davon ausgehen, dass 25 bis 50 % Prozent der mit Borrelien infizierten Personen im weiteren Verlauf auch an Borreliose erkranken. Zurzeit wird noch erforscht, ob die unterschiedlichen Genospezies von Borrelia burgdorferi ursächlich für die verschiedenen Krankheitsbilder sind. Diese werden von den Ärzten möglicherweise nicht immer korrekt als „Borreliose“ diagnostiziert.
Eine prophylaktische einmalige Gabe von Antibiotika – zumindest nach einer Zeckenattacke in einem Hoch-Risiko-Gebiet – wird von einigen Forschern empfohlen. Diese Empfehlung stammt aus den USA, wo es nur eine Genospezies gibt, und ist deshalb in Europa sehr umstritten. Um das Infektionsrisiko nach einem Zeckenstich besser abschätzen zu können, kann die Zecke gegebenenfalls auf Borrelienbefall mittels PCR-Untersuchung untersucht werden. Ein Befall mit Borrelien ist jedoch nicht mit einer Krankheitsübertragung gleichzusetzen. Denn bis es nach einem Zeckenstich zu einer Übertragung der Borrelien kommen kann, muss – anders als bei dem FSME-Virus – eine gewisse Zeit vergehen. Die Angaben darüber schwanken zwischen 6 und 48 Stunden.[15] Fest steht jedoch: Je länger eine mit Borrelien befallene Zecke gesaugt hat, umso höher ist das Risiko einer Übertragung. Ein Teil der Infektionen erfolgt aber auch durch das unsachgemäße Entfernen der Zecke, wenn diese gequetscht wird.
Zecken sollten so schnell wie möglich entfernt werden. Hierzu bieten sich spezielle Pinzetten an, die vorzugsweise aus Edelstahl gefertigt sein sollten (siehe auch ausführlich unter Zeckenstich).
Übertragung
Überträger des Bakteriums sind in der Regel Zecken, die den Erreger beim Saugen nach einigen Stunden (in der Regel in einem Zeitfenster von 8 bis 12 Stunden nach dem Einstich) auf den Menschen übertragen. In Deutschland ist das vor allem die Zecke Ixodes ricinus, auch Gemeiner Holzbock genannt. Zecken sind weltweit Überträger von mehr als 50 Krankheiten (siehe Zeckenstich).
Als weitere Überträger der Borreliose werden von Wissenschaftlern auch Stechmücken diskutiert, wobei in bisherigen Studien[16][17] nur eine sehr geringe Durchseuchung von Mücken festgestellt wurde. Parasitologen der Universität Bonn sind in letzter Zeit der Frage nachgegangen, ob Laufmilben (Trombiculidae), darunter die in Deutschland heimische Herbstmilbe (Neotrombicula autumnalis), als Vektoren für das Bakterium Borrelia burgdorferi infrage kommen, es ergaben sich aber keine konkreten Hinweise. Allerdings ist hier unklar, ob diese Spinnentiere tatsächlich in der Lage sind, Borrelien auf den Menschen zu übertragen. Bekannt ist jedoch eine Übertragung durch Bremsen.[18]
Eine direkte Übertragung der Borrelien von Mensch zu Mensch ist nicht bekannt, d. h. erkrankte Personen sind nicht ansteckend. Dagegen besteht bei einer infizierten Frau in der Schwangerschaft die Gefahr von Totgeburten oder der Schädigung des ungeborenen Kindes. Eine Übertragung durch Blutprodukte ist zwar grundsätzlich möglich, wird aber bislang als unwahrscheinlich angesehen. Nach Auskunft des Robert-Koch-Instituts ist die Borreliose nicht sexuell übertragbar. Genügend aussagekräftige Studien fehlen hierzu jedoch.
Diagnose
Die Diagnostik der Borreliose geschieht in erster Linie klinisch, das heißt nicht anhand von Laborparametern, sondern aus dem Krankheitsbild, das der Patient zeigt. Der Zeckenstich selbst ist dabei eindeutiger Anlass zu Nachbeobachtung auf Symptome des Frühstadiums. Die Deutsche Borreliose-Gesellschaft empfiehlt dabei eine Frist von vier bis sechs Wochen für das Auftreten einer Wanderröte (Erythema migrans, s. u.), aber ebenso für Fieber ohne Hautrötung.[19]
Unter den klinischen Symptomen gelten als krankheitsbeweisend nur die Wanderröte (jedoch wird bei bis zu 50 % der Borreliosefälle im Frühstadium keine Wanderröte beobachtet[19]) und im III. Stadium die chronische Hautentzündung ACA. Bei einer Untersuchung am Universitätsklinikum Freiburg von 1990 bis 2000, die 86 Fälle von akuter Neuroborreliose umfasste, berichteten sogar nur 23 % der Patienten von einer Wanderröte.[20] Behauptungen, die Wanderröte träte in 90 % der Erkrankungsfälle auf,[21] sind unbelegt. Die vielen weiteren Symptome, die zahlreiche Organsysteme betreffen, können daher nur durch Ausschlussdiagnosen und Labortests den Verdacht einer Infektion erhärten.
Wie im Folgenden erörtert, gibt es umfangreiche Labortests, die sich aber alle durch mangelnde Sensitivität auszeichnen. Das bedeutet, dass ein negativer Test die Krankheit nicht ausschließt.[22]
Ein großes Problem bei der Feststellung der Borreliose ist die laborchemische (serologische) Unterscheidung zwischen einer abgeheilten Borreliose (Seronarbe) und einer noch aktiven, therapiebedürftigen Borreliose. Es kommt deshalb nach wie vor zu falsch negativen und falsch positiven serologischen Befunden.
In der Serologie werden in der Routinediagnostik Antikörpertests eingesetzt. Das sind in der Regel der ELISA und der Westernblot, auch Immunoblot genannt. Manche Labore führen auch einen Immunfluoreszenztest (IFT) durch. Solche Tests können nur die Antikörper messen, d. h. feststellen, ob ein Erregerkontakt stattgefunden hat oder nicht. Es ist jedoch durch diese Verfahren nicht möglich, den Krankheitsverlauf einer Borreliose zu kontrollieren. Deshalb ist es auch nicht möglich, aufgrund der serologischen Ergebnisse nach einer Behandlung mit Antibiotika festzustellen, ob diese wirksam waren und die Borreliose nun ausgeheilt ist. Hinzu kommt, dass die einzelnen Testverfahren nicht standardisiert sind und eine unterschiedliche Spezifität und Sensitivität aufweisen. Bei sehr sensitiven Tests besteht oftmals das Problem von sogenannten Kreuzreaktionen. Das bedeutet, der Test zeigt ein positives Borrelien-Ergebnis an, der Betreffende hat aber keine Borreliose (Alpha-Fehler, falsch-positiv). Das wird durch andere Erreger, wie zum Beispiel durch andere Spirochäten wie Treponema pallidum oder Treponema denticola, Leptospiren, aber auch durch das Epstein-Barr-Virus oder Zytomegalievirus verursacht. Genauso kommen falsch negative Ergebnisse vor (Beta-Fehler). Die Serologie ist vor allem in den frühen Phasen nicht zuverlässiger als 50 %. Neuere Tests sollen inzwischen eine etwas höhere Zuverlässigkeit aufweisen, die mit einer Sensitivität von ca. 70 bis 80 % angegeben wird. Allerdings sind dies Angaben der jeweiligen Labors, die nicht überprüft wurden.
In der Regel wird eine sogenannte Zwei-Stufen-Testung durchgeführt. Es wird erst ein ELISA-Test eingesetzt, der jedoch Kreuzreaktionen bzw. polyklonale Antikörperstimmulierungen durch andere Krankheitserreger aufweisen und deshalb falsch-positiv sein kann. Das Ergebnis wird durch einen Immuno- bzw. Westernblot verifiziert und bestätigt. Bei negativem ELISA und fortbestehendem klinischen Verdacht auf eine Borreliose empfiehlt sich die Durchführung eines Westernblot.
Es werden gerade in der Frühphase viele Borreliose-Fälle übersehen, da innerhalb der ersten Wochen noch keine messbaren Antikörperspiegel gegen Borrelienantigene gebildet werden (sogenannte diagnostische Lücke = Zeitpunkt von der Infektion bis zur ersten Antikörperproduktion). Daher sollte in Frühstadien nicht das Ergebnis einer Blutuntersuchung abgewartet werden, sondern unverzüglich bei entsprechendem klinischen Verdacht antibiotisch therapiert werden, da bei frühzeitiger Behandlung die Heilungschancen am größten sind. Eine Wanderröte (Erythema migrans) muss sofort behandelt werden. Auch bei einer floriden, behandlungsbedürftigen Borreliose können Entzündungsparameter wie BKS, CRP und andere akute-Phase-Proteine unauffällig bleiben, so dass normale Werte dieser akute-Phase-Proteine (Entzündungsparameter) nicht geeignet sind, eine aktive Borreliose auszuschließen.
In späteren Stadien ist die Sensitivität der serologischen Testmethoden (ELISA) in der Regel höher. Sie soll im zweiten Stadium bei etwa 70 bis 90 % liegen. Bei einem Verdacht auf eine manchmal klinisch wenig spezifische Neuroborreliose ist in der Regel eine Liquoruntersuchung angezeigt, bei der durch Feststellung entzündlicher Liquorveränderungen und den Nachweis einer borrelienspezifischen intrathekalen Antikörpersynthese sich gegebenenfalls ein solcher bestätigen lässt.[1] Allerdings kann es hierbei bei ca. 30 % zu falschen negativen Ergebnissen kommen. Im Frühstadium der Neuroborreliose ist oftmals noch keine Infektion mit Borrelien nachweisbar. In diesen Fällen könnte das kürzliche entdeckte Chemokin CXCL13 (ein B-Lymphozyten anziehendes Protein) eine wichtige Rolle spielen, da es bereits in Frühstadien der Erkrankung im Liquor von Patienten mit Neuroborreliose deutlich erhöht ist. Nach der bisherigen Studienlage ist die Spezifität dieses Markers mit der intrathekalen Antikörpersynthese vergleichbar. Darüber hinaus sinkt die Konzentration von CXCL13 im Liquor unter Behandlung rasch ab und hilft somit eine aktive Infektion von einer Seronarbe zu unterscheiden. Bislang ist dieser Marker jedoch noch nicht in der klinischen Diagnostik etabliert, sondern wird nur im Rahmen von Studien (z. B. an der Universitätsklinik der LMU München) untersucht. Auch wenn lediglich eine Beteiligung peripher Nerven vorliegt, kann die Liquordiagnostik negativ sein. Die Zuverlässigkeit der Liquordiagnostik ist auch von der Erfahrung des Labors, zugrunde gelegten Kriterien für die Auswertung, Präparationszuverlässigkeit sowie den verwendeten diagnostischen Verfahren abhängig. In Deutschland sind zahlreiche Borrelien-Serologien mit unterschiedlichen Antigenkompositionen auf dem Markt, die eine große Bandbreite hinsichtlich der Sensitivität und Spezifität aufweisen. Deshalb kann es vorkommen, dass mit einem Test negativ und mit einem anderen positive Ergebnisse festgestellt werden. Es besteht weder eine Genehmigungspflicht für die Borrelien-Serologie, noch ist eine Teilnahme an Ringversuchen verpflichtend.
In einigen spezialisierten Labors und Instituten wird bei positiver Serologie und fraglicher Erregeraktivität ein Lymphozytentransformationstest (LTT) durchgeführt. Dieser Test gehört seit 2005 zu den in Deutschland akkreditierten Laborverfahren zum Nachweis zellulärer T-Zellreaktivitäten. Ein positives Ergebnis deutet auf Borrelien-spezifische T-Zellen im Blut hin und unterstützt den klinischen Verdacht auf eine aktive Borreliose. Dass wirklich eine enge Korrelation zwischen einem positiven LTT und der Krankheitsaktivität besteht, ist allerdings bislang in größeren klinische Studien nicht untersucht. Die Deutsche Borrelliose-Gesellschaft empfiehlt den LTT in ihren Leitlinien mit Einschränkungen[23], die Deutsche Gesellschaft für Neurologie bezeichnet ihn in ihren Empfehlungen als ungeeignet.[24] Der LTT wird seit April 2006 von den Gesetzlichen Krankenkassen nicht mehr übernommen. Der PCR-Nachweis stellt eine weitere Diagnosemethode dar, mit der eine aktive Borreliose festgestellt werden kann. Hier wird aus dem Untersuchungsmaterial DNA aufgearbeitet und mittels der PCR-Reaktion ein borrelienspezifisches Fragment vervielfältigt (amplifiziert). Dieser Test ist hochspezifisch, stellt gleichzeitig aber hohe Anforderungen an Laborpersonal und -ausrüstung. Die Sensitivität ist stark abhängig vom untersuchten Körpermaterial (Liquor bei einer Neuroborreliose etwa 20 bis 30 %, Synovialflüssigkeit bei einer Lyme-Arthritis und Haut bei einer Dermato-Borreliose etwa 70 %). Ein negatives Ergebnis schließt eine aktive Borreliose deshalb nicht aus. Wenn Kontaminationen sowie tote Erreger ausgeschlossen werden konnten, ist ein positives Ergebnis ein Hinweis auf eine aktive Borreliose. Der Direktnachweis von Borrelien-DNA aus Zecken mittels PCR wird von verschiedenen Firmen bzw. Laboren angeboten. Die Kosten für die von den Krankenkassen nicht getragene Leistung liegen je nach Anbieter zwischen 10 und 100 Euro. Ein positiver Nachweis in der Zecke besagt nicht, dass auch im Menschen eine Infektion stattgefunden hat. Als alleiniger Nachweis für eine Borrelieninfektion wird dieser Test von keiner Fachgesellschaft empfohlen. Therapien, die sich alleine auf diesen Befund ohne Symptome und Serologie berufen, sind nicht indiziert.
Differentialdiagnose
In Abhängigkeit vom Krankheitsstadium ist die Differenzialdiagnose weit gefächert. Es empfiehlt sich, weitere durch Zecken übertragene Erkrankungen und andere Infektionen (Babesiose, Rickettsiose, Leptospirose, Bartonellose und andere) auszuschließen.
Die Borreliose kann, ähnlich wie eine Lues, eine Vielzahl von Erkrankungen „imitieren“. Es ist bei einer neurologischen Beteiligung an andere Ursachen, insbesondere Infektion mit neurotropen (auf die Nerven wirkende) Viren und Bakterien zu denken. Wichtig ist bei neurologischen Beschwerden die zuverlässige Abgrenzung gegenüber einer multiplen Sklerose, um eine schwerwiegende Fehlbehandlung mit Steroiden anstatt mit Antibiotika zu vermeiden. Bei Gelenkentzündungen kommen die aktivierte Arthrose, die rheumatoide Arthritis und andere Gelenkentzündungen in Frage. Eine Abgrenzung der Lyme-Enzephalopathie von einem chronischen Erschöpfungssyndrom ist häufig schwierig.
Weitere wichtige Differenzialdiagnosen – insbesondere bei erfolgloser Therapie – sind Tumoren und andere Systemerkrankungen.
Krankheitsverlauf
Nach einer Infektion kann es zur Bildung von Antikörpern gegen Borrelien kommen, ohne dass es gleichzeitig zu Krankheitssymptomen kommt. Die Serologie kann noch Jahre nach einer ausgeheilten Borreliose positiv sein. Eine sichere Diagnose kann oft anhand der Krankheitssymptome, des Krankheitsverlaufs, der Krankengeschichte und der serologischen Befunde gestellt werden. Bei Unklarheiten kann manchmal ein Behandlungsversuch mit Antibiotika Klarheit bringen. Allerdings besagt das Ansprechen auf die Antibiotikagaben nicht, dass eine aktive Borreliose vorliegt, und umgekehrt belegt ein Nicht-Ansprechen nicht, dass die Krankheit ausgeheilt ist. Welches die optimale Therapie gegen Borreliose darstellt, ist umstritten.
In der Regel äußert sich eine Lyme-Borreliose durch schwere Symptome, die sich im Laufe der Jahre verschlimmern. Symptomfreie Latenz-Zeiten sind allerdings möglich. Ein Verschwinden der Symptome bedeutet deshalb nicht, dass die Erreger eliminiert sind. In der Frühphase sind die Symptome einer Borreliose einem grippalen Infekt (ohne Husten und Schnupfen) ähnlich. In diesem Stadium kommt es häufig zu Myalgien (Muskelschmerzen) und Arthralgien (Gelenkschmerzen), die mit einer Fibromyalgie (chronische Schmerzerkrankung) verwechselt werden können. Dieselben Symptome werden auch oft nach einer Antibiotikabehandlung beschrieben. Wenn Symptome wie bei einer Fibromyalgie oder einem Chronic-Fatigue jedoch gleich bleiben und ohne Antibiotikagaben keine Verschlechterung eintritt, muss man eher davon ausgehen, dass die Beschwerden nicht durch Borrelia burgdorferi verursacht werden, vor allem, wenn in der Vorgeschichte keine borreliosetypischen Leitsymptome aufgetreten sind. Dies gilt auch für andere unspezifische Symptome wie Schüttelfrost, Fieber, Gelenk- und Muskelschmerzen, Erschöpfungszustände und Depressionen.
Nach einer durchgemachten Borreliose besteht keine Immunität.
Stadien
Es gibt eine Reihe von Symptomen, die für die einzelnen Stadien typisch sind. Daneben kann sich die Borreliose aber zusätzlich durch eine Vielzahl von unspezifischen Beschwerden wie Müdigkeit, Kopfschmerzen, Fieber, Nackensteifigkeit, Sehbeschwerden, Schwindel, Übelkeit und Erbrechen sowie psychische Veränderungen manifestieren.
1. Stadium: Lokalinfektion
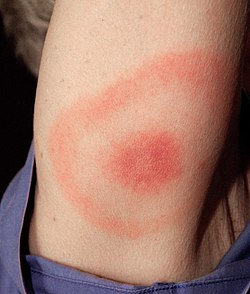
Ab Übertragung des Erregers kann es nach einer Inkubationszeit von meist 5–29 Tagen zu einer Lokalinfektion der Haut kommen, die mit einem charakteristischen Hautausschlag, dem Erythema (chronicum) migrans (Wanderröte) einhergeht.[7] Ein Fleck, heller roter Ring oder auch Doppelring, typischerweise im Zentrum blasser als am Rand, weitet sich von der Einstichstelle der Zecke nach außen aus (daher der Name). Abgesehen davon, dass manchmal ein Jucken oder auch Stechen auftritt, schmerzt diese Rötung (ein Erythem) nicht.
Die Wanderröte erscheint oft zusammen mit unspezifischen Allgemeinsymptomen wie Fieber, Kopfschmerz oder Magen-Darm-Beschwerden (s. u.). Klassischerweise bilden diese Symptome zusammen das klinische Stadium I der Borreliose. Das Erythema migrans ist ein eindeutiges Symptom für eine Borrelieninfektion, allerdings tritt nicht in allen Fällen von Borreliose-Infektionen eine Wanderröte auf; aus dem Nichtvorliegen nach einem Zeckenstich kann also nicht geschlossen werden, dass keine Borreliose-Infektion erfolgt ist.[25][26] Das Erythem verschwindet manchmal ohne Therapie, kann aber auch über Monate bestehen. Ein Rückgang des Erythema migrans ist kein Beleg für eine Heilung, da der Erreger gestreut haben kann.
Typischerweise tritt innerhalb von 10–14 Tagen nach der erfolgten Borrelieninfektion eine sogenannte „Borreliose-Grippe“ auf mit allen Symptomen einer Grippe außer den üblichen Infektzeichen wie Rhinitis oder Husten. Fieber kann, muss aber nicht mit dabei sein. Des Weiteren können sich erhebliche Müdigkeits- und Erschöpfungsgefühle oder neu auftretende und wieder verschwindende Gelenkschmerzen zeigen. Meist besteht ein diffuses Krankheitsgefühl mit beeinträchtigtem Allgemeinbefinden, ohne dass eine Krankheit richtig fassbar wird. Auch Darmsymptome sind nicht selten und werden dann als Sommerdarmgrippe diagnostiziert, ohne dass der Zusammenhang zur Borrelieninfektion hergestellt wird. Dies gilt vor allem für die Fälle, die keine Wanderröte entwickeln. Ab dem Zeitpunkt der Borrelieninfektion werden auch Impfungen, Narkosen oder banale Infekte deutlich schlechter vertragen.[19]
Im ersten Stadium kann die Borreliose noch gut mit Antibiotika (Doxycyclin) behandelt werden. Notwendig ist jedoch eine ausreichend lange und hoch genug dosierte Therapie. Was ausreichend ist, ist in der Wissenschaft umstritten.
2. Stadium: Streuung des Erregers
Nach etwa 4 bis 16 Wochen,[27] nach anderen Quellen nach 20 bis 59 Tagen[7] breiten sich die Erreger im ganzen Körper aus. Die Inkubations- und Latenzzeit kann auch länger sein. Der Patient leidet dann an grippeähnlichen Symptomen wie Fieber und Kopfschmerzen, was die Erkennung der Krankheit erschwert. Charakteristisch sind starke Schweißausbrüche. Durch die Ausbreitung im Körper kann es zu einem Befall der Organe, der Gelenke und Muskeln sowie des zentralen und peripheren Nervensystems kommen. Leitsymptome in diesem Stadium sind oftmals das Bannwarth-Syndrom mit starken radikulitischen Schmerzen und eine Facialisparese, die sich in einem schiefen Gesicht zeigt. Außerdem zeigen sich reaktiv benigne Hyperplasien lymphatischer Zellen, die in Form von Schwellungen vor allem im Bereich der Ohrläppchen sichtbar sind und als Lymphadenosis cutis benigna bezeichnet werden. Typisch sind auch von Gelenk zu Gelenk springende Arthritiden und Myalgien. Weiterhin kann es zu Störungen des Tastsinns, Sehstörungen und Herzproblemen, wie Sinustachykardien und Karditis kommen, was sich manchmal durch Herzklopfen und hohen Blutdruck sowie Pulsbeschleunigung bemerkbar macht. Das Immunsystem ist in diesem Stadium oft nicht mehr in der Lage, die Infektion zu bewältigen. Borrelien halten sich nur kurz im Blut, jedoch länger im Bindegewebe auf. Hier sind sie vom Immunsystem und durch Antibiotika nur schwer zu eliminieren.
Ein problematischer Sonderfall ist die sogenannte Neuroborreliose, die zu vielfältigen Erkrankungen der peripheren Nerven und bei circa 10 % der Erkrankungen auch des Zentralnervensystems führen kann. In aller Regel tritt sie in der frühen Erkrankungsphase auf (bis etwa 10 Wochen), in der noch keine Antikörper gebildet wurden. Deshalb müssen in diesem Stadium ausreichend Antibiotika gegeben werden. Die Wahl des Antibiotikums richtet sich nach dem Befall und der Erkrankungsform. Wenn die Borreliose nicht rechtzeitig und ausreichend behandelt wird, so kann die Erkrankung fortschreiten und zu bleibenden Organschäden führen.
3. Stadium: Spätstadium
Nach mehreren Monaten können Infizierte, die nicht oder nicht ausreichend behandelt wurden, schwere und chronische Symptome entwickeln. Monate-, aber auch jahrelange symptomfreie Latenzzeiten mit anschließendem Wiederaufflackern der Erkrankung sind möglich. So tritt die Akrodermatitis chronica atrophicans Herxheimer (ACA) oft erst nach Jahren auf. Es kann auch zu einer chronischen rezidivierenden Lyme-Arthritis mit vielfältigen Krankheitsbildern kommen oder auch zu einem Befall des zentralen und peripheren Nervensystems (Neuroborreliose) mit Polyneuropathie, Borrelien-Meningitis, Lyme-Enzephalomyelitis oder einer Enzephalitis. Ebenso sind chronische Erkrankungen der Sinnesorgane und der Gelenke und Muskeln möglich. Die chronischen Erkrankungen der Gelenke werden Lyme-Arthritis genannt. Es kann aber auch zu einer entzündlichen Bursitis oder Arthrose kommen. Die unterschiedlichen Erreger scheinen verschiedene Krankheitsbilder auszulösen: Während bei einem Teil der Patienten fast nur die Gelenke betroffen sind, kommt es bei anderen hauptsächlich zu neurologischen Störungen. Daneben gibt es auch eine Gruppe von Patienten, die Herzprobleme meist verbunden mit Gefäßentzündungen haben. Mischformen sind möglich. Viele Borreliose-Patienten klagen über rasche Ermüdung und chronische Müdigkeit, die sich auch durch ausreichend Schlaf nicht beseitigen lässt.
Therapie
Die Behandlung einer Borreliose stellt auf Grund der Möglichkeit des vielfachen Organbefalls eine interdisziplinäre Herausforderung der verschiedenen Fachdisziplinen in der Medizin dar. Die Prognose nach frühzeitiger antibiotischer Behandlung im ersten Stadium ist gut. Die in manchen Quellen zitierten 95 % „folgenloser“ Ausheilung von Neuroborreliose beziehen sich jedoch nur auf den Anteil der Patienten mit akuter Neuroborreliose, die nach einem Jahr beschwerdefrei waren. Bei chronischer Neuroborreliose betrug der Anteil dagegen nur 66 %.[20]
Da gerade im Frühstadium außer der Wanderröte kein sicherer Krankheitsnachweis möglich ist, stellt sich beim Auftreten von unspezifischen grippeähnlichen Symptomen oder Gelenkschmerzen kurz nach einem Zeckenstich die Frage einer Güterabwägung zwischen den Risiken und Nebenwirkungen einer auf Verdacht durchgeführten, eventuell überflüssigen mehrwöchigen Antibiotikatherapie einerseits und andererseits – bei Nichtdurchführung, aber auch einem denkbaren Misserfolg einer solchen Maßnahme – den möglichen gesundheitlichen, sozialen und finanziellen Folgen eines jahrelangen chronischen Leidens, das im Extremfall bis hin zur Erwerbsunfähigkeit führt. Dabei muss auch das relativ sichere therapeutische Fenster von etwa vier Wochen von der Infektion bis zum Beginn des II. Stadiums, der Erregerstreuung und Beginn der systemischen Krankheit, berücksichtigt werden.
Im Frühstadium der Infektion sind Tetracycline wie Doxycyclin wegen der Zellgängigkeit und ihrer Wirksamkeit gegen andere, ebenfalls durch Zeckenstiche übertragene Erreger das Mittel der Wahl. Da die Generationenfolge der Borrelien deutlich länger ist als bei vielen anderen Erregern,[28] enthalten neuere Therapieempfehlungen wie die der Deutschen Borreliose-Gesellschaft von 2008 eine Mindestdauer von 4 Wochen für die Monotherapie mit Antibiotika. Auch die Dosis ist zum Beispiel mit 400 mg Doxycyclin pro Tag höher als bei älteren Therapieempfehlungen, um die erforderlichen Serumspiegel und Gewebskonzentrationen zu erreichen. Zeigt das Mittel bei einer vorhandenen Wanderröte keinen Effekt, ist spätestens nach zwei Wochen ein Wechsel des Antibiotikums angeraten.[19]
Des Weiteren ist zu berücksichtigen, dass eine Herxheimer-Reaktion, welche durch eine effektive antibiotische Therapie erzeugt wird, auftreten kann.
Die Verabreichungsform und Länge der Antibiotikatherapie richtet sich nach dem Krankheitsstadium, aber insbesondere nach der Krankheitsmanifestation. Hierbei sind individuelle Risikofaktoren der Patienten (wie z. B. eine Antibiotikaallergie oder eine Niereninsuffizienz) zu berücksichtigen. Je länger eine Borrelieninfektion dauert, umso schwieriger wird es, eine komplette Erregereliminierung zu erreichen. Für die Therapie stehen grundsätzlich verschiedene Antibiotika zur Verfügung. Es wird zwischen extrazellulären (außerhalb der Körperzellen) und intrazellulären Formen (in Zellen des Bindegewebes, des Knorpels, Fettgewebe und der Haut) des Erregers unterschieden. Im Laborversuch hat sich dabei gezeigt, dass der Erreger binnen Stunden zwischen beiden Formen wechseln kann.[29] Dementsprechend sind die Antibiotika auszuwählen. Diese müssen auch „zellgängig“ sein, um die in den Körperzellen befindlichen Erreger abtöten zu können.
Besonders Spätformen der Borreliose (persistierend) weisen intrazelluläre Erreger auf. Unterstützt wird die Zellengängigkeit durch gleichzeitige Gabe von Hydroxychloroquin, das einen basischen Zustand in den Zellen herbeiführt und das Eindringen des Antibiotikums in die Zellen unterstützt. Zellgängige Antibiotika sind Clarithromycin und Azithromycin in Kombination mit Hydroxychloroquin. Es liegen jedoch keine überzeugenden klinischen Studien zur Wirksamkeit von Hydroxychloroquin vor.
Ein extrazellulär wirkendes Antibiotikum ist Ceftriaxon, das intravenös über 14–21 Tage in einer Dosis von 2 g pro Tag gegeben wird. In einer Metaanalyse von acht europäischen Studien mit insgesamt 300 Patienten mit definitiver Neuroborreliose zeigte sich kein statistisch signifikanter Unterschied beim Behandlungserfolg zwischen einer oralen Doxycyclin-Therapie im Vergleich zur intravenösen Therapie mit Penicillin G oder Ceftriaxon.[30] Therapieversager sind mit allen Antibiotika und darauf basierenden Behandlungsregimen festgestellt worden. Unklar ist jedoch die Häufigkeit, die von einigen Autoren mit 10 bis 20 % angegeben werden und von anderen mit etwa 50 %. Zur Antibiotika-Behandlung von mehr als 14 bis 30 Tagen bei Patienten mit Lyme-Borreliose gibt es kein ausreichendes Studienmaterial.
Eine aktuelle placebo-kontrollierte Studie konnte bei der Lyme-Enzephalopathie lediglich eine vorübergehende Besserung nach Durchführung einer 10-wöchigen Ceftriaxon-Behandlung zeigen. Offen blieb jedoch, ob diese Besserungen auf eine direkte Wirkung oder auf „positive Nebenwirkungen“ des Antibiotikums zurückzuführen waren. [31] Studien zu einer möglichen besseren Wirksamkeit anderer Antibiotika-Klassen bei diesem Krankheitsbild liegen nicht vor.
Wie in den Empfehlungen der Deutschen Gesellschaft für Neurologie zur Neuroborreliose ausgeführt ist, ist die optimale Behandlungsdauer vor allem mit den intravenös zu verabreichenden Antibiotika Ceftriaxon und Cefotaxim unklar. Eine Behandlungsdauer über 3 Wochen ergibt jedoch keinen zusätzlichen Effekt. Inzwischen werden auch in fortgeschrittenen Stadien andere Antibiotika als Cephalosporine eingesetzt, unter anderem Tetracycline, da die β-Lactam-Antibiotika (wie Ceftriaxon, Cefotaxim) im Verdacht stehen, sogenannte zystische oder zellwandlose Formen zu verursachen und bei intrazellulärer Persistenz nicht ausreichend zu wirken. Einige Behandlungsformen bestehen aus einer Kombination von intravenösen und oralen Antibiotika, wobei jedoch insgesamt keine überzeugenden Nutzenbelege vorliegen.
Fraglich ist, ob die Lyme-Borreliose im III. Stadium noch heilbar ist. Für eine Behandlung der Lyme-Borreliose mit Cholestyramin ergibt sich weder eine wissenschaftliche Rationale noch ergeben sich hierzu Argumente aus kontrollierten Studien. Eine solche Behandlung wird nicht empfohlen.
Leitlinien
Als praktische Richtlinie für Ärzte zur Behandlung der Lyme-Borreliose existieren Medizinische Leitlinien der "Infectious Diseases Society of America" (IDSA), die 2006 veröffentlicht wurden. Die IDSA-Leitlinien[32] wurden im Konsensus mit anderen großen amerikanischen Fachgesellschaften erarbeitet und geben unter Berücksichtigung der aktuellen Studienlage evidenzbasierte Empfehlungen zur Diagnostik und Therapie dieses Krankheitsbilds. International haben diese Leitlinien einen wesentlichen Einfluss auf die Therapie der Lyme-Borreliose. In Deutschland arbeiten einige große ärztliche Fachgesellschaften seit einiger Zeit an der Erstellung einer gemeinsamen Leitlinie. Die Fertigstellung ist für Ende 2012 geplant.[33] Bereits verfügbar sind die Leitlinien der Deutschen Gesellschaft für Neurologie zur Behandlung der Neuroborreliose.[34]
Kontroverse
Einige Ärzte haben auch bei unklaren Symptomen und ohne Nachweis einer Borrellien-Infektion eine "chronische" Borreliose diagnostiziert. Dieses Krankheitsbild wird von der Medizin im Allgemeinen nicht anerkannt, da bisher kein Nachweis dafür erbracht werden konnte, dass eine weiter andauernde Infektion mit Borrelien bei dieser Art von Beschwerden tatsächlich eine Rolle spielt.[35] Chronische Beschwerden nach einer nachgewiesenen Lyme-Borreliose werden daher im Allgemeinen als "Post-Lyme Syndrom" bezeichnet. Trotzdem befürworten einige Ärzte schlecht belegte Therapieverfahren, zu denen auch antibiotische Langzeit-Therapien über Monate oder Jahre gehören. Patientenvertretergruppen wie zum Beispiel die "International Lyme And Associated Diseases Society" (ILADS) strengten daher eine Überprüfung der in den USA existierenden Leitlinien an (herausgegeben durch die IDSA). Am 1. Mai 2008 ließ der Generalstaatsanwalt von Connecticut, Richard Blumenthal, diese IDSA-Leitlinien überprüfen.[36] Begründet wurde die Untersuchung durch die Feststellung seines Ministeriums, die IDSA-Leitlinienkommission habe in unsachgemäßer Weise Überlegungen und Erkenntnisse abweichender medizinischer Meinungen und Nachweise ignoriert oder bagatellisiert. Des Weiteren konnte einflussreichen Mitgliedern der Leitlinien-Kommission geheimgehaltene Kapitalinteressen und Verflechtungen mit Versicherungsunternehmen und Pharmakonzernen nachgewiesen werden. Um den Beschuldigungen entgegenzutreten setzte die IDSA eine erneute Prüfung der Leitlinien durch ein unabhängiges Ärztegremium fest. Nach einer erneuten Prüfung der aktuellen Studien- und Datenlage wurde die Gültigkeit der IDSA-Leitlinien 2010 bestätigt.[37].
Vorbeugung
Zeckenstichvermeidung
Eine absolut sichere Methode zur Zeckenstichvermeidung ist nicht bekannt. Der Schutz vor Zeckenstichen beschränkt sich auf das mechanische Absuchen, die Verwendung von Abwehrsprays als Vorbeugung sowie auf das Tragen von Kleidung, die den Körper weitgehend bedecken soll. Sinnvoll ist es, den Zecken keine Möglichkeit zu geben, in und unter die Kleidung zu kriechen. Bei intensiver Arbeit in Büschen und hohen Gräsern kann man vorher mit handelsüblichen Abwehrsprays sowohl die Haut als auch die Kleidung einsprühen. Die darin enthaltenen Stoffe können den Zeckenbefall abwehren und verhindern. Ein regelmäßiges sorgfältiges Absuchen des Körpers – gerade bei Kindern, die tagsüber im Freien spielen – ist die sicherste Methode, Zeckenstiche zu vermeiden. Darüber hinaus sollte man es vermeiden, in den Zeckenmonaten leicht bekleidet durch hohes Gras, Büsche und Sträucher zu laufen. Besonders auf leicht feuchtem Gras lauern die Zecken auf ihren nächsten Wirt. Bei trockenem und heißem Wetter ziehen sich Zecken zurück.
Immunisierung
Aktive und passive Immunisierungen stehen bisher für Europa nicht zur Verfügung. In den USA war für wenige Jahre ein wirksamer rekombinanter Impfstoff auf der Basis von OspA (äußeres Membranprotein von Bbsl) zugelassen, den der Hersteller aus kommerziellen Gründen vom Markt genommen hat. Wegen der Heterogenität der Stämme (mindestens 7 OspA-Serotypen) ist die Entwicklung eines wirksamen Impfstoffes für Europa schwierig, so das Robert-Koch-Institut 2007. In der Veterinärmedizin wird jedoch bei Hunden eine Impfung gegen Borrelien auch in Deutschland durchgeführt. Ihre Wirkung ist umstritten, da die durch die Impfung induzierten Antikörperspiegel rasch wieder abfallen und infolge des Vorhandenseins einer Vielzahl endemischer Borrelien-Stämme das Aufbauen kreuzreagierender und schützender Impftiter fraglich ist.
Grundsätzlich ist es möglich, die Bauanleitung der Eiweiße vieler Impfstoffe in pflanzliches Erbmaterial einzuschleusen, so dass derart veränderte Pflanzen zu Impfstoffproduzenten werden. Die von den Forschern derart veränderten Tabakpflanzen produzierten ein Ospa genanntes Eiweiß, welches sich ebenfalls auf der Oberfläche der Borreliose-Erreger findet. Eine zur Wirksamkeit zusätzlich notwendige Verknüpfung des genannten Eiweißes mit Fettsäuren wurde durch die Pflanzen ebenfalls erreicht. In Versuchen mit Mäusen erwies sich der so produzierte Tabak-Impfstoff im Vergleich zu aus Bakterienkulturen gewonnenem Impfstoff als ähnlich wirksam, jedoch ist dieser bislang noch nicht für den Menschen zugelassen.[38]
Einzelnachweise
- ↑ 1,0 1,1 Leitlinie Neuroborreliose der Deutschen Gesellschaft für Neurologie. In: AWMF online (Stand 2008)
- ↑ Ötzi hatte Borreliose und vertrug keine Milch, Tiroler Tageszeitung, Onlineausgabe vom 28. Februar 2012, abgerufen am 9. März 2012.
- ↑ Hubert Filser: Der Risikopatient aus dem Eis, Süddeutsche Zeitung online vom 29. Februar 2012, abgerufen am 9. März 2012.
- ↑ Lyme-Borreliose kann in Gärten erworben werden, Pressemitteilung des RKI vom 1. Juni 2001 zum Epidemiologischen Bulletin 21/2001
- ↑ Lyme-Borreliose kann in Gärten erworben werden, Pressemitteilung des RKI vom 1. Juni 2001 zum Epidemiologischen Bulletin 21/2001
- ↑ Rauter C, Oehme R, Diterich I, Engele M, Hartung T: Distribution of Clinically Relevant Borrelia Genospecies in Ticks Assessed by a Novel, Single-Run, Real-Time PCR J Clin Microbiol. 2002 January; 40(1): 36–43.
- ↑ 7,0 7,1 7,2 B. Wilske et al., Lyme-Borreliose in Süddeutschland: Epidemiologische Daten zum Auftreten von Erkrankungsfällen sowie zur Durchseuchung von Zecken (Ixodes ricinus) mit Borrelia burgdorferi
- ↑ Thomas Kistemann: Regionale Verbreitung der Lyme-Borreliose Nationalatlas des Leibniz-Institut für Länderkunde, 20. April 2012, abgerufen am 27. April 2012. Es wurde jeweils das 3. Abrechnungsquartal (Juli bis September) der Jahre 2007 bis 2009 betrachtet.
- ↑ Robert Koch Institut: Epidemiologisches Bulletin Nr. 12 vom 29. März 2010, S. 351–355 (PDF, 1MB). Die für Tschechien ausgewiesene Inzidenz lautet für 2005: 36 Fälle pro 100.000 Einwohner
- ↑ Robert Koch Institut: Epidemiologisches Bulletin Nr. 17 vom 2. Mai 2011, S. 134 (PDF, 2MB).
- ↑ Smith R, Takkinen J, Editorial team: Lyme borreliosis: Europe-wide coordinated surveillance and action needed?, Euro Surveill. 2006;11(25):pii=2977, (englisch), abgerufen am 27. April 2012.
- ↑ Lindgren E, Jaenson T: Lyme Borreliosis in Europe WHO Europe (englisch, PDF), abgerufen am 27. April 2012.
- ↑ Robert Koch Institut: Epidemiologisches Bulletin Nr. 12 vom 29. März 2010, S. 351–355 (PDF, 1MB)
- ↑ Lindgren E, Jaenson T: Lyme Borreliosis in Europe WHO Europe (englisch, PDF), abgerufen am 27. April 2012.
- ↑ 15,0 15,1 O. March, Transmissionsrisiko von Borrelia burgdorferi nach Zeckenstich: Follow-up Studie
- ↑ Kosik-Bogacka D, Bukowska K, Kuźna-Grygiel W: Detection of Borrelia burgdorferi sensu lato in mosquitoes (Culicidae) in recreational areas of the city of Szczecin. In: Ann Agric Environ Med. 9. Jahrgang, Nr. 1, 2002, S. 55–7, PMID 12088398 (Online (Memento vom 8. Juni 2007) [PDF]).
- ↑ Kosik-Bogacka DI, Kuźna-Grygiel W, Górnik K: Borrelia burgdorferi sensu lato infection in mosquitoes from Szczecin area. In: Folia Biol. (Krakow). 54. Jahrgang, Nr. 1-2, 2006, S. 55–9, PMID 17044261.
- ↑ Luger SW: Lyme disease transmitted by a biting fly. In: N. Engl. J. Med. 322. Jahrgang, Nr. 24, Juni 1990, S. 1752, PMID 2342543.
- ↑ 19,0 19,1 19,2 19,3 Deutsche Borreliose-Gesellschaft: Diagnostik und Therapie der Lyme-Borreliose
- ↑ 20,0 20,1 R. Kaiser, Verlauf der akuten und chronischen Neuroborreliose nach Behandlung mit Ceftriaxon, Nervenarzt. 2004 Jun;75(6):553-7.
- ↑ Patrick Hünerfeld: Zecken-Borreliose, Fernsehsendung des SWR 2012.
- ↑ ILADS – Leitlinien Zusammenfassung, Version vom 13. Oktober 2004 (englisch)
- ↑ Diagnostik und Therapie der Lyme-Borreliose - Leitlinien. (PDF; 534 KB) Deutsche Borreliose-Gesellschaft, 1. April 2008, S. 7-8, abgerufen am 1. Juli 2012 (Lua-Fehler in Modul:Multilingual, Zeile 149: attempt to index field 'data' (a nil value)).
- ↑ Leitlinien der DGN 2008 - Neuroborreliose. (PDF; 176 KB) Deutsche Gesellschaft für Neurologie, 2008, S. 1;8, abgerufen am 1. Juli 2012 (Lua-Fehler in Modul:Multilingual, Zeile 149: attempt to index field 'data' (a nil value)).
- ↑ http://www.zecken.de/index.php?id=306
- ↑ http://www.bfbd.de/de/zeckenstich-was-nun.html
- ↑ AKH-Consilium – Lyme-Borreliose
- ↑ Neuroborreliose: Einige Hintergründe für Krankheitsverlauf und lange Behandlungdauer, Eine Literaturzusammenstellung von Dr. rer.nat. Joachim Gruber
- ↑ Brorson O, Brorson SH.: A rapid method for generating cystic forms of Borrelia burgdorferi, and their reversal to mobile spirochetes. APMIS. 1998 Dec;106(12):1131-41
- ↑ Halperin JJ, Shapiro ED, Logigian E, et al: Practice parameter: treatment of nervous system Lyme disease (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. In: Neurology. 69. Jahrgang, Nr. 1, Juli 2007, S. 91–102, doi:10.1212/01.wnl.0000265517.66976.28, PMID 17522387 (neurology.org).
- ↑ Fallon BA, Keilp JG, Corbera KM, et al: A randomized, placebo-controlled trial of repeated IV antibiotic therapy for Lyme encephalopathy. In: Neurology. 70. Jahrgang, Nr. 13, März 2008, S. 992–1003, doi:10.1212/01.WNL.0000284604.61160.2d, PMID 17928580.
- ↑ IDSA-Leitlinien
- ↑ Projekthomepage "Leitlinie Lyme Borreliose" auf der Seite der AWMF
- ↑ AWMF-Letilinie: Neuroborreliose
- ↑ Wormser GP, Schwartz I (July 2009). "Antibiotic treatment of animals infected with Borrelia burgdorferi"
- ↑ Attorney General: Attorney General’s Investigation Reveals Flawed Lyme Disease Guideline Process, IDSA Agrees To Reassess Guidelines, Install Independent Arbiter
- ↑ Stephen Singer (22. April 2010). "No changes to Lyme disease treatment". Associated Press.
- ↑ Glenz K, Bouchon B, Stehle T, Wallich R, Simon MM, Warzecha H: Production of a recombinant bacterial lipoprotein in higher plant chloroplasts. In: Nat. Biotechnol. 24. Jahrgang, Nr. 1, Januar 2006, S. 76–7, doi:10.1038/nbt1170, PMID 16327810 (doi.org).
Literatur
Bücher
- Hans Horst: Zeckenborreliose Lyme-Krankheit bei Mensch und Tier. Demeter, ISBN 3-934211-49-6
- Patrick Oschmann, Peter Kraiczy: Lyme-Borreliose und Frühsommer-Meningoenzephalitis. Uni-Med, ISBN 3-89599-408-1
- Norbert Satz: Klinik der Lyme-Borreliose. Huber, ISBN 3-456-83430-6
- Wolfgang Kristoferitsch: Neuropathien bei Lyme-Borreliose. Springer, ISBN 3-211-82108-2
- H. Krauss, A. Weber, M. Appel, B. Enders, A. v. Graevenitz, H. D. Isenberg, H. G. Schiefer, W. Slenczka, H. Zahner: Zoonosen. Von Tier zu Mensch übertragbare Infektionskrankheiten. 3. Auflage, Deutscher Ärzte-Verlag, Köln 2004, ISBN 3-7691-0406-4
Aufsätze
- Brian Fallon: Die neuropsychiatrischen Manifestationen der Lyme-Borreliose Übersetzung der englischsprachigen Version 1992.PDF
- Hans-Peter Wirtz: Zecken als Krankheitsüberträger: Was tun bei einem Stich? In: Biologie in unserer Zeit. Jg. 2001, Bd. 31, Nr. 4, S. 229–238.
- Helge Kampen: Vektor-übertragene Infektionskrankheiten auf dem Vormarsch? Wie Umweltveränderungen Krankheitsüberträgern und -erregern den Weg bereiten. In: Naturwissenschaftliche Rundschau. Jg. 2005, Bd. 58, Nr. 4, S. 181–189.
- H. Krauss et al.: Borreliosen. In: Zoonosen. Von Tier zu Mensch übertragbare Infektionskrankheiten. 3. Auflage, 2004, Deutscher Ärzteverlag. PDF 6 Seiten)
- Dieter Hassler: Phasengerechte Therapie der Lyme-Borreliose In: Chemother. J. Jg. 2006, Bd. 15, S. 106–111. PDF (6 Seiten)
- C. Rauter et al.: Distribution of clinically relevant Borrelia genospecies in ticks assessed by a novel, single-run, real-time PCR. In: J. Clin. Microbiol. Jg. 2002, Bd. 40, S. 36-43. PMID 11773090
- Nau, R. et al.: Lyme-Borreliose – aktueller Kenntnisstand. In: Dtsch Arztebl Int. Nr. 106(5), 2009, S. 72–81 (Artikel). PDF